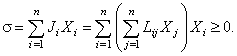Мікроскопічна зворотність у рівновазі
Принцип мікроскопічної зворотності у рівновазі стверджує, що в системі, яка перебуває у стані рівноваги, будь-який молекулярний процес та протилежний йому процес відбуваються, в середньому, з однаковою швидкістю. Це визначення відповідає формулюванню принципу, даному Р.С. Толманом 1924 року. Однак багато науковців плутали значення мікроскопічної зворотності та детального (досконалого) балансу; мабуть, найкраще було б розглядати обидва терміни, бо вони є тісно зв’язаними синонімами.
В термодинаміці поняття зворотних і незворотних процесів вживається в дещо іншому сенсі. Оскільки розглядаються системи, замікроскопічним станом яких прослідкувати неможливо, поняттня звороності зосереджується на макроскопічних станах. Один і той же макроскопічний стан еквівалентний дуже великому числу мікроскопічних станів.
Зворотнім процесом у термодинаміці називається такий процес, при якому термодинамічну систему можна перевести з кінцевого макроскопічного стану в початковий, проходячи через ті ж проміжні стани.
Зміни в мікроскопічному стані не приймаються до уваги. Зворотний процес у термодинаміці є обов'язково рівноважним процесом, тобто кожен проміжний стан є рівноважним станом.
Перехід від нерівноважного стану до рівноважного є незворотним процесом. Наприклад, якщо заповнити газом половину посудини, а потім вийняти перегородку, газ заповнить всю посудину. Цей процес неможливо провести в зворотному напрямку, хоча можна провести уявний експеримент, замінивши всі швидкості атомів газу на протилежні. Результатом цього експерименту було б збирання газу в одній половині посудини, однак в практичних випадках такі процеси не реалізуються.
Незворотність процесів переходу від нерівноважного до рівноважного стану підсумовує другий закон термодинаміки.
Перехід від мікроскопічних рівнянь руху, які характеризуються зворотністю, до термодинаміки, в якій зворотність втрачається, залишається певною мірою викликом для фізики.
16. Феноменологические уравнения не являются единственными общими соотношениями термодинамики необратимых процессов. Другими общими соотношениям являются уравнение Онзагера для скорости роста энтропии, а также онзагерзское соотношение взаимности, устанавливающее, что при правильном выборе системы координат Lik - Lki.
17. В термодинамике необратимых процессов Ларс Онзагер сформулировал следующее положение: при небольших отклонениях от равновесиятермодинамический поток можно представить в виде линейной комбинации термодинамических движущих сил:
|
|
(4.1) |
Здесь ![]() -
движущая сила, сопряжённая с потоком
-
движущая сила, сопряжённая с потоком ![]() ;
она определяет прямой
эффект.
;
она определяет прямой
эффект. ![]() -
движущие силы, сопряжённые с другими
потоками; они характеризуют в
(4.1) перекрёстные
эффекты по
отношению к процессу i.
Коэффициенты L называютфеноменологическими
коэффициентами:
-
движущие силы, сопряжённые с другими
потоками; они характеризуют в
(4.1) перекрёстные
эффекты по
отношению к процессу i.
Коэффициенты L называютфеноменологическими
коэффициентами: ![]() -
при прямом эффекте,
-
при прямом эффекте, ![]() -
при перекрёстных эффектах, причём
влияние прямого эффекта существенно
превышает влияние перекрёстных эффектов:
-
при перекрёстных эффектах, причём
влияние прямого эффекта существенно
превышает влияние перекрёстных эффектов:
|
|
|
Соотношения типа (4.1) для систем, близких к равновесию, называют соотношениями взаимности Онзагера или линейными соотношениями. С учётом (4.1) производство энтропии системы можно представить в виде квадратичной формы:
|
|
|
Данная квадратичная форма является положительно определённой (доказательство приводится в разделе "Характеристика производства энтропии"). Л. Онзагер также определил, что в линейных соотношениях (4.1) недиагональные коэффициенты равны [9]:
|
|
(4.2) |
т.е.
матрица феноменологических коэффициентов
должна быть симметричной. Иными словами,
если на поток
,
соответствующий необратимому процессу i,
действует сила ![]() необратимого
процесса j,
то сила
действует
на поток
необратимого
процесса j,
то сила
действует
на поток ![]() с
тем же коэффициентом
с
тем же коэффициентом ![]() .
Соотношения (4.2) называют принципом
симметрии феноменологических
коэффициентов.
.
Соотношения (4.2) называют принципом
симметрии феноменологических
коэффициентов.
18. Теорема Пригожина — теорема термодинамики неравновесных процессов. Согласно этой теореме, стационарному состоянию системы (в условиях, препятствующих достижению равновесного состояния) соответствует минимальное производство энтропии. Если таких препятствий нет, то производство энтропии достигает своего абсолютного минимума — нуля. Доказана И. Р. Пригожиным в 1947 из соотношений взаимности Онзагера. Теорема Пригожина справедлива, если кинетические коэффициенты в соотношениях Онзагера постоянны; для реальных систем она справедлива лишь приближённо, поэтому минимальность производства энтропии для стационарного состояния не является столь общим принципом, как максимальность энтропии для равновесного состояния.
Формулировка: В стационарном состоянии продукция энтропии внутри термодинамической системы при неизменных внешних параметрах является минимальной и константной. Если система не находится в стационарном состоянии, то она будет изменяться до тех пор, пока скорость продукции энтропии, или, иначе, диссипативная функция системы не примет наименьшего значения.