
19. Принцип Ле Шателье
При известных ΔH реакции или при Δn ≠ 0 на химическое равновесие можно воздействовать изменением температуры или давления. Химическое равновесие может быть смещено изменением концентраций реагентов. Другими словами, равновесие можно сместить внешним воздействием, руководствуясь принципом Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (ΔH > 0), но повышение температуры может сделать эти реакцию осуществимой. РеакцияCO + 1/2O2 = CO2, ΔH < 0 с повышением температуры будут смещаться в сторону исходных веществ.
Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO + O2 = 2CO2, протекающая с уменьшением Δn, при повышении общего давления сместится в сторону образования СO2.
Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличение концентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира)
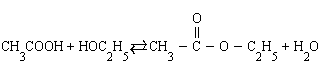
увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов.
20. РАВНОВЕСНОЕ СОСТОЯНИЕ - состояние, в к-рое приходит термодинамич. система при постоянных внеш. условиях. Р. с. характеризуется постоянством во времени термодинамич. параметров и отсутствием в системе потоков вещества и энергии (см. в ст. Равновесие термодинам ическое).
устойчивость равновесия термодинамического системы относительно малых вариаций её термодинамических параметров (объёма, давления, температуры и др.). В общем случае состояние равновесия характеризуется минимальным значением потенциала термодинамического, соответствующего независимым в условиях опыта переменным. Например, при независимых переменных энтропии, объёме и числе молей компонентов для термодинамического равновесия системы необходимо, чтобы была минимальна её внутренняя энергия U. Из этого требования вытекает, во-первых, что должна быть равна нулю первая вариация dU при малых вариациях переменных и постоянстве полной энтропии, объёма и числа частиц. Отсюда как условие равновесия следует постоянство температуры и давления для всех фаз, а также равенство значений химического потенциала для каждого из компонентов в сосуществующих фазах. Выполнение этих условий ещё не гарантирует Устойчивость термодинамическая системы. Из требования минимума U вытекает ещё одно условие – положительное значение второй вариации d2U. Оно приводит к ряду термодинамических неравенств, которые являются условиями термодинамической устойчивости. Например, одно из них состоит в положительном значении теплоёмкости системы при постоянном объёме, а другое – в убывании давления с ростом объёма при постоянной температуре. В общем случае условие Устойчивость термодинамическая можно сформулировать в виде следующего принципа: внешнее воздействие, выводящее систему из состояния равновесия, стимулирует в нём процессы, стремящиеся ослабить результаты этого воздействия (см. Ле Шателье – Брауна принцип). Полная теория Устойчивость термодинамическая как для гомогенных, так и для гетерогенных систем была разработана в конце 19 в. Дж. У.Гиббсом. Свойством Устойчивость термодинамическая может в определённой степени обладать и метастабильное равновесие, которому хотя и соответствует минимум внутренней энергии или др. термодинамического потенциала, но этот минимум лежит выше основного минимума, определяющего наиболее устойчивое состояние (см. Метастабильное состояние).
21. В основе процессов обмена клетки со средой и внутреннего метаболизма лежит сложная сеть организованных определенным образом во времени и пространстве различных реакций. В результате этих процессов изменяются концентрации различных веществ, численность отдельных клеток, биомасса организмов, могут изменяться и другие величины, например величина трансмембранного потенциала в клетке. Изменения всех этих переменных величин во времени и составляют кинетику биологических процессов. Основные исходные предпосылки при описании кинетики в биологических системах в общем такие же, как и в химической кинетике.
биологическая кинетика характеризуется следующими особенностями.
1. В качестве переменных выступают не только концентрации веществ, но и другие величины.
2. Переменные изменяются не только во времени, но и в пространстве.
3. Биологическая система пространственно гетерогенна, и условия взаимодействия реагентов могут быть различны в разных точках системы.
4. Существуют специальные механизмы саморегуляции, действующие по принципу обратной связи.
Основная задача в биофизике сложных систем состоит в том, чтобы получить характеристики различных динамических режимов и выяснить условия и значения параметров, при которых они реализуются в живой клетке.
22. Будь-яку кінетичну біологічну систему можна охарактеризувати як сукупність деяких параметрів, значення яких підтримуються незмінними протягом часу спостереження за системою, та змінних у часі. Параметрами є, наприклад, такі фізичні величини, як температура, вологість, електрична провідність мембрани, рН і т. д. Залежно від досліджуваних біосистем змінними вважаються: в екології – чисельність виду, у біофізиці – мембранний потенціал, у мікробіології – кількість мікроорганізмів, у біохімії – концентрація речовини тощо. процеси, які відбуваються в біологічних системах, як правило, є нелінійними; відповідно нелінійними є й математичні моделі цих процесів. Проте існують методи якісного аналізу диференціальних рівнянь, які дають можливість виявити важливі загальні властивості (закономірності) моделі, не знаходячи в явному вигляді невідомі функції. Ці методи базуються на таких експериментальних фактах. По-перше, різні функціональні процеси в біосистемах суттєво відрізняються один від одного за часом проходження або характерними швидкостями. Так, наприклад, у біосистемі одночасно мають місце швидкі процеси ферментативного каталізу (час обороту ферменту становить с), фізіологічні процеси (час – хвилини) та процеси репродукції (від кількох хвилин і більше). По-друге, якщо окремі (проміжні) стадії загального процесу в біосистемі характеризуються часом і найповільніша стадія має час такий, що , то визначальною ланкою всього процесу є -та стадія, і загальний час проходження процесу практично збігається з . Отже, наявність такої часової ієрархії процесів у біосистемі дає можливість значно спростити вихідну модель, звівши її, по суті, до кінетичного опису поведінки найбільш повільної стадії.
адекватні моделі реальності- Ті моделі, які можуть бути покладені в основу подальшого прогнозу, прийняття рішення та здійснення управління.
23. СТАЦИОНАРНОЕ СОСТОЯНИЕ БИОСИСТЕМ
Особенностью биосистем является то, что они не просто открытые системы, но системы, находящиеся в стационарном состоянии. При стационарном состоянии приток и отток энтропии происходят с постоянной скоростью, поэтому общая энтропия системы не меняется во времени (dS / dt = 0)..
Благодаря с.с. за счет непрерывного обмена энергией с внешней средой биосистемы не только находятся на удалении от термодинамического равновесия (низший возможный энергетический уровень, на котором энтропия системы максимальна) и сохраняют свою работоспособность, но и поддерживают во времени постоянство своих параметров. Немаловажно и то, что в стационарном состоянии биосистемы обладают способностью к авторегуляции.
По крайней мере два основных свойства характерны для стационарного состояния биосистем. Прежде всего это его энергетический уровень, который показывает, насколько далеко система удалена от термодинамического равновесия. Живой организм, как отмечал Оствальд, - это очаг установившихся стационарных состояний. Их уровни не случайны. Они возникли в процессе эволюции и обеспечивают организму наиболее выгодный энергетический обмен в данных конкретных условиях.
Особенностью биосистем является то, что многие протекающие в них процессы находятся на значительном удалении от термодинамического равновесия. В этих условиях для системы характерен очень интенсивный обмен энтропией с внешней средой, что обеспечивает возможность протекания в ней процессов самоорганизации и возникновение специфических динамических структур.
Другой интересной особенностью стационарного состояния является определенная степень его устойчивости. Если стационарное состояние достаточно устойчиво, то после не очень сильного отклонения от него, вызванного каким-либо возмущающим воздействием, система может вновь вернуться в исходное положение. Типичный пример такой устойчивости - содержание глюкозы в крови человека. Как известно, оно достаточно постоянно, но это постоянство поддерживается за счет непрерывного притока и оттока глюкозы. Если ввести в кровь какое-то количество этого углевода, то его содержание увеличится. Однако через некоторое время содержание глюкозы в крови вернется к исходному уровню.
Причина устойчивости стационарных состояний была вскрыта Пригожиным. Он доказал, что в стационарном состоянии биосистемы обладают очень интересным свойством. Если система не очень удалена от состояния термодинамического равновесия, член diS / dt в уравнении (1) при стационарном состоянии сохраняет свое положительное значение, но стремится к минимуму
24. Динамічні біосистеми, які описуються за допомогою звичайних диференціальних рівнянь, називаються точковими системами. Це означає, що в будь-якій точці такої системи значення шуканої величини (напр., концентрації речовини) зберігається з часом. Однак загальнішим є випадок, коли значення змінних є різними в різних точках простору. Наприклад, коли одночасно з реакцією, яка відбувається на деякій ділянці системи, реагенти дифундують, переходячи до іншої ділянки.
25. Динамічні біосистеми, які описуються за допомогою звичайних диференціальних рівнянь, називаються точковими системами. Це означає, що в будь-якій точці такої системи значення шуканої величини (напр., концентрації речовини) зберігається з часом. Однак загальнішим є випадок, коли значення змінних є різними в різних точках простору. Наприклад, коли одночасно з реакцією, яка відбувається на деякій ділянці системи, реагенти дифундують, переходячи до іншої ділянки.
Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:
1s <
2s <
2 p <
3s <
3p <
4s <
3d <
4p <
5s <
4d <
5p <
6s <
4f![]() 5d <
6p <
7s <
5f
6d...
5d <
6p <
7s <
5f
6d...
Атом водорода имеет один электрон, который может находиться на любой орбитали. Однако, в основном состоянии он должен занимать 1s-орбиталь, имеющую самую низкую энергию.
В атоме калия последний девятнадцатый электрон может заселить либо 3d-, либо 4s-орбиталь. В соответствии с принципом минимума энергии, электрон занимает 4s-орбиталь, что подтверждается экспериментом.
Следует обратить внимание на неопределенность записи 4f 5d и 5f 6d. Оказалось, что у одних элементов более низкую энергию имеет 4f-подуровень, а у других - 5d-подуровень. То же самое наблюдается для 5f- и 6d-подуровней.
