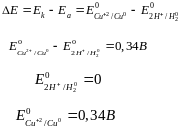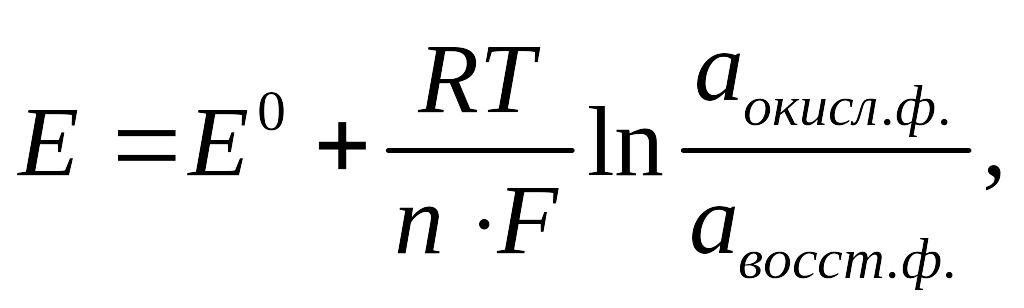- •1,2Основные понятия химии:
- •3,4.Законы стехиометрии
- •5,6.Строение атома, квантовые числа
- •21. Химическая связь
- •7. Химическая термодинамика
- •8. Химическая кинетика
- •9. Химическая кинетика. Температура
- •11. Химическое равновесие
- •12, 13. Растворы
- •14,15. Растворы. Давление. Осмос. Законы Вант-Гоффа и Рауля
- •16,17.Электролиты и неэлектролиты
- •18. Электролитическая диссоциация воды, pH
- •19.Гидролиз. Гидролиз солей
- •22, 23.Овр (окислительно-восстановительные реакции)
- •Классификация овр
- •30. Коррозия металлов
- •24. Взаимодействие металлов с водой, растворами солей, щелочей и кислот
24. Взаимодействие металлов с водой, растворами солей, щелочей и кислот
При обычной температуре с водой взаимодействуют только наиболее активные металлы, стоящие в ряду активностей до магния.
РЯД АКТИВНОСТЕЙ МЕТАЛЛОВ:
[Li, Rb, K, Ba, Sr, Ca, Na], Mg, Al, Mn, Zn, Cr, Fe, Cd,Co, Ni, Sn, Pb, H , Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
С водой: по схеме: Мe0 + H2O → Me+n(OH)n + H2↑; 2Na + 2H2O → 2NaOH + H2 ↑
Магний реагирует с горячей водой: Мg0 + 2H2O → Mg (OH)2 + H2 ↑;
В раскаленном состоянии железо реагирует с перегретым водяным паром: 2Fe + 3H2O = Fe2O3 + 3H2
С растворами щелочей реагируют металлы, оксиды и гидроксиды которых обладают амфотерными свойствами: В щелочных средах неустойчивы Al, Zn и их сплавы.
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑; Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2↑
Взаимодействие с растворами солей: каждый более активный металл (не взаимодействующий с водой) способен вытеснить стоящий за ним металл из растворов его солей.
Cu + AgNO3 = Cu(NO3)2 + Ag; Cu + Hg(NO3)2 = Cu(NO3)2 + Hg
Взаимодействие с кислотами: по отношению к Ме все кислоты можно разделить на: обычные (все, кроме H2SO4(конц) и HNO3) и кислоты окислители; по отношению к кис-там все металлы можно разделить на активные (пассивирующиеся) [Fe, Cr, Al] и малоактивные (благородные) [Au, Pt, Ir, Os].
Активными металлами считают металлы, расположенные в ряду активностей до водорода.
С обычными кислотами взаимодействуют только активные металлы.
Реакция протекает по схеме: Me 0+ H+1An → Me+nAn + H20 металл + кислота → соль +водород
Zn + H2SO4 разб.→ ZnSO4 + H2↑
Взаимодействие концентрированной H2SO4 с металлами:
не взаимодействует с благородными металлами;
в концентрированном состоянии без нагревания пассивирует Fe, Cr и Al;
с остальными металлами реакция протекает по схеме:
SO2
Me + H2SO4 = MeSO4 + S0 + H2O
H2S-2
Глубина восстановления S+6 определяется активностью металла: чем активнее металл, тем больше меняется степень окисления.
Характер взаимодействия HNO3 с металлами:
не взаимодействует с благородными металлами;
в концентрированном состоянии без нагревания пассивирует Fe, Cr и Al;
с остальными металлами реакция протекает по схеме:
N+4O2
Me0 + HN+5O3 = Me+nNO3 + N+2O + H2O
N2+1O
N-3H4NO3
Глубина восстановления N+5 зависит:
I) от активности металла: чем активнее металл, тем глубже происходит изменение степени ок-ия.
II) от концентрации кислоты: чем более разбавлена кислота, тем глубже происходит изменение степени окисления.
4HNO3 (конц.)+ Cu = Cu(NO3)2+ 2NO2 + 2H2O
8HNO3 (разб.) + 3Cu =3Cu(NO3)2 + 2NO +4H2O
10HNO3 (с.разб.) + 4Са =4Ca(NO3)2 + NН4 NO3 + 3H2O
.::Электролиз
Электролизом - называется совокупность процессов, сопровождающих прохождение электрического тока через растворы или расплавы электролитов.
Процессы при электролизе
направленное движение ионов электролита к электродам: положительно заряженные ионы (катионы) перемещаются к катоду, отрицательно заряженные анионы – к аноду
окислительно-восстановительные процессы на электродах. при электролизе, как при любой электрохимической реакции, на аноде протекает процесс окисления, т.е. процесс отдачи электронов, а на катоде - процесс восстановления, т.е. процесс присоединения электронов
образовавшиеся на электродах вещества (ионы или нейтральные молекулы) могут покидать поверхность электродов, кроме того, они могут вступать во вторичные взаимодействия.
В первую очередь, должны окисляться наиболее сильные восстановители – вещества, имеющие наиболее отрицательное значение электродных (окислительно– восстановительных) потенциалов. Впервую очередь, восстанавливаются наиболее сильные окислители, имеющие наибольшие положительные значения электродных (окислительно–восстановительных) потенциалов.
На катоде:
В первую очередь восстанавливаются катионы малоактивных металлов, расположенных в ряду стандартных электродных потенциалов после водорода.
Катионы металлов средней активности, стоящие в ряду между Аl и Н2, восстанавливаются совместно с катионами водорода (из молекул Н2О). При этом на катоде одновременно протекают два процесса:
а) Процесс восстановления ионов металла средней активности: Me+n + ne = Me0
б) процесс восстановления ионов водорода из воды: 2H2О + 2e = Н2 + 2ОН –
Катионы активных металлов от Li до Аl (включительно) при электролизе водных растворов не восстанавливаются. На катоде в этом случае восстанавливаются только ионы водорода из воды и выделяется водород из воды: 2H2О + 2e = Н2 + 2ОН –
При электролизе растворов сильных кислот, характеризующихся высокими концентрациями ионов водорода, на катоде восстанавливаются ионы водорода Н +: 2H + + 2e = Н20
На аноде:
Если анод нерастворимый (инертный), то в первую очередь на нем окисляются анионы бескислородных кислот (за исключением ионов фтора F - )2Сl – – 2e = Cl2
Анионы кислородсодержащих кислот (оксокислот), например, SO4 2–, NO3 –, СО3 2–, РO4 3–, а также фторид ион (F –), не окисляются при электролизе водных растворов. При этом на аноде идет процесс окисления молекул Н2О: 2H2О – 4e = O2 + 4H +
При электролизе растворов щелочей на аноде окисляются ионы ОН –: 4ОН – – 4e = 2O2 + 2 H2O
Возможные процессы на аноде:
-окисление анионов кислотных остатков 2Сl - - 2e = Cl2 процесс 1
-окисление анионов гидроксила 4ОН - - 4e = 2O2 + 2 H2O процесс 2
-окисление молекул воды 2H2О - 4e = O2 + 4H + процесс 3
-окисление материала анода Me 0 - ne = Me +n процесс 4
Возможные процессы на катоде: (не зависят от материала катода, а зависят от положения металла в ряду стандартных электродных потенциалов)
-восстановление катионов металла Me +n + ne = Me 0 процесс 5
-восстановление ионов водорода 2H + + 2e = Н2 процесс 6
-восстановление молекул воды 2H2O + 2e = Н2 + 2ОН – процесс 7
Электроды: инертные и активные
Электрод (анод), материал которого может окисляться в процессе электролиза, называется активным (растворимым) электродом. Не окисляющийся в процессе электролиза и служащий только для подвода электрического тока электрод называется инертным.
Первый закон Фарадея. Масса вещества, выделяющегося на электроде при электролизе, пропорциональна количеству прошедшего через раствор электричества. m = k · Q , где
k - коэффициент пропорциональности (электрохимиический эквивалент) (г/Кл);Q - количество электричества(Кл).Q = I · t; k=M(экв)/F, где F= 96500 Кл/моль - постоянная Фарадея
.::Электрохимия
Возникновение скачка потенциала на границе раздела металл - водный раствор электролита
Равновесие в растворе: Ме + H2O D Me+n ∙ mH2O + ne-
Потенциал, возникающий на поверхности металла при погружении его в какой – либо раствор называется электродным потенциалом металла. Е, ε, φ Размерность – вольт - [В]
Величина электродного потенциала – мера электрохимической активности металла.
Направление перехода катионов металла в жидкую фазу:
Направление перехода определяется двумя факторами: Ме + H2O D Me+n ∙ mH2O + ne-
средней энергией катионов в металле Ет (зависит только от природы металла)
средней энергией катионов в растворе Еж (зависит от природы металла, концентрации (активности) катионов в растворе и от природы растворителя)
Если Ет > Еж - катионы преимущественно переходят из твердой фазы в жидкую. При этом Ме заряжается отрицат., а р-р - положит. Если Ет < Еж - катионы преимущественно переходят из жидкой фазы в твердую. При этом металл заряж. Положит., а р-р - отрицательно. Если Ет = Еж - преимущественный переход катионов из одной фазы в другую отсутствует и на границе фаз устанавливается равновесие.
Измерение величины электродного потенциала: абсолютную величину электродного потенциала измерить невозможно; относительную величину электродного потенциала измеряют при сравнении его с потенциалом электрода, выбранного в качестве эталона. При этом составляется гальванический элемент. В качестве электрода сравнения часто используют стандартный водородный электрод.
У стройство
водородного электрода
стройство
водородного электрода
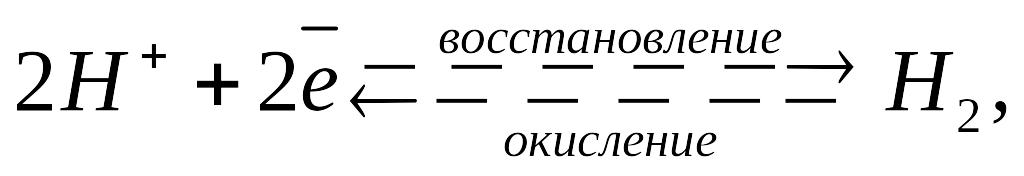 Условная запись: Pt,H2
/ H2SO4
; Равновесие на водородном электроде:
Условная запись: Pt,H2
/ H2SO4
; Равновесие на водородном электроде:
Pt Потенциал водородного электрода зависит:
Р-р кис-ты от давления газообразного водорода; от концентрации ионов водорода в
растворе кислоты; от температуры. Устройство водородного электрода: 1-
проводник к измерительному устройству; 2-корпус электрода; 3-платиновая пластина, покрытая слоем губчатой платины (“платиновой чернью”); 4-трубка для подачи газообразного водорода; 5-р-р кислоты;6-электролитический ключ. Водородный электрод, находящийся при стандартных условиях: [ Н+] = 1 моль/л, Р = 101,3 кПа, Т = 298 К, называют стандартным водородным электродом. Потенциал такого электрода условно принят за 0 при любой температуре.
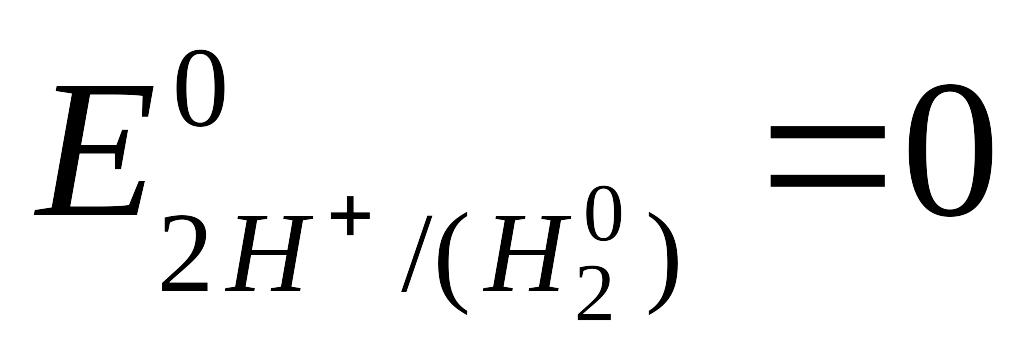 Стандартным
электродным потенциалом металла
называется
Стандартным
электродным потенциалом металла
называется
равновесный потенциал металла, находящегося в контакте с
раствором собственной соли при стандартных условиях ([Men+] = I моль/л, Т=298К) и измеренный относительно стандартного водородного электрода.
Для определения стандартного электродного потенциала меди составляют гальванический элемент, состоящий из медного электрода и стандартного водородного электрода. Условная запись этого элемента: Анод (-)Pt/H2/H2SO4//CuSO4/Cu(+) Катод;Определение стандартного электродного потенциала цинка: условная запись:Анод(-)Zn/ZnSO4//H2SO4/H2,Pt(+)Катод
Располагая Ме в порядке возрастания величин их стандартных электродных потенциалов, можно получить ряд, называемый рядом стандартных электродных потенциалов.Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Ca, Ni, Sn, Pb, H, Sb, Bi, Cu, Ag, Hg, Pd, Pt, Au. Чем левее в ряду находится металл и чем меньше величина его электродного потенциала, тем он химически активнее, тем легче металл окисляется, но тем труднее восстанавливаются его ионы. Все металлы, стоящие в ряду напряжений левее водорода, вытесняют (восстанавливают) его из разбавленных кислот (типа серной или соляной, анионы которых не проявляют окислительных свойств), а стоящие правее водорода, его не вытесняют. Zn + H2SO4 → ZnSO4 + H2↑ Наиболее активные металлы, стоящие в ряду до Mg, вытесняют водород даже из воды. Каждый металл этого ряда, не разлагающий воду, вытесняет (восстанавливает) следующие за ним металлы из растворов их солей.Чем дальше расположены металлы в ряду друг от друга, тем большую Э.Д.С. будет иметь составленный из них гальванический элемент
.::Понятие о гальваническом элементе
Для практического определения величины электродного потенциала составляют гальванический элемент. Гальванический элемент – это устройство, состоящее, как минимум, из двух электродов (полуэлементов), в котором химическая энергия превращается в электрическую.
Электродвижущая сила (Э.Д.С.) гальванического элемента
|
Уравнение Нернста позволяет рассчитать потенциалы электродов при условиях, отличающихся от стандартных
Е-потенциал электрода в условиях, отлич. от стандартных, В; Е0-стандартный электродный потенциал, В; R-универсальная газовая постоянная, F-число Фарадея, n-число электронов, принимающих участие в окислительно-восстановительном процессе; a окисл. ф. - активность окисленной формы, моль/л; a восст. ф. - активность восстановительной формы, моль/л;
|
Для разбавленных растворов
[C окис.ф] и [C восст.ф.] - концентрации, окисленной и восстановленной форм, моль/л. |
|
Ур-ие Нернста для металлич. электрода:
|
Формула Нернста справедлива для расчетов электродных потенциалов, характеризующих только обратимые процессы, находящиеся в состоянии равновесия.
|
Обратимый процесс позволяет достичь состояния равновесия, характеризующегося балансом как по зарядам, так и по веществу. Если потеря электронов на электроде осуществляется каким-либо одним веществом, а присоединение - другим, то процесс будет необратимым.
Виды обратимых электродов: металлические электроды I рода, металлические электроды II рода, окислительно - восстановительные электроды, газовые электроды.
Металлические электроды I рода представляют собой металл, погруженный в раствор соли этого металла. медный электрод Cu / CuSO4; цинковый электрод Zn/ZnSO4. Потенциалы таких электродов зависят от активности ионов металла в растворе.
Металлические электроды II рода редставляют из себя металлические электроды, покрытые труднорастворимым соединением данного металла, например, солью, оксидом или гидроксидом, и погруженные в раствор хорошо растворимого соединения, имеющего общий с труднорастворимым соединением анион.(хлорсеребряный электрод - Ag/AgCl/KCl каломельный электрод - Hg/Hg2Cl2/KCl.) Потенциалы металлических электродов II рода будут определяться активностью (концентрацией) общего с труднорастворимым соединением аниона в растворе.
Окислительно – восстановительные электроды (редокс - электроды) образуются при погружении графита или иного инертного металла (платина, золото, иридий и др.) в окислительно - восстановительную среду. Возникающий при этом окислительно - восстановительный потенциал (редокс - потенциал) обусловлен равновесием: окисленная форма Û восстановленная форма
Газовые электроды представляют собой металлический проводник, контактирующий одновременно и с газом и с раствором, содержащим ионы данного газа. Напр.: водородный, хлорный, кислородный электроды.
.::Поляризация
Виды поляризации:
В зависимости от причин, вызывающих поляризацию, различают два ее вида:
Концентрационная поляризация;
Электрохимическая поляризация.
Концентрационная поляризация
Вызывается изменением концентрации реагентов в приэлектродном слое вследствие протекания процессов окисления или восстановления при прохождении электрического тока.
Концентрационная поляризация имеет место вследствие замедленной диффузии ионов, приводящей к тому, что лимитирующей стадией становятся либо подвод реагентов к электроду. либо отвод продуктов реакций от электрода.
Электрохимическая поляризация
вызвана замедленностью электрохимической реакции разряда или образования ионов при данной плотности тока, то есть, замедленностью собственно электрохимической стадии процесса.
Зависимость скорости реакции от потенциала - характерная особенность электрохимических реакций.
Типы гальванических элементов
Различают следующие типы гальванических элементов:
ХИМИЧЕСКИЕ – составлены из разных электродов,
КОНЦЕНТРАЦИОННЫЕ – составлены из одинаковых электродов, с разными концентрациями электролита.
ТЕРМОГАЛЬВАНИЧЕСКИЕ - составлены из одинаковых электродов, работающих при разных температурах..