- •1,2Основные понятия химии:
- •3,4.Законы стехиометрии
- •5,6.Строение атома, квантовые числа
- •21. Химическая связь
- •7. Химическая термодинамика
- •8. Химическая кинетика
- •9. Химическая кинетика. Температура
- •11. Химическое равновесие
- •12, 13. Растворы
- •14,15. Растворы. Давление. Осмос. Законы Вант-Гоффа и Рауля
- •16,17.Электролиты и неэлектролиты
- •18. Электролитическая диссоциация воды, pH
- •19.Гидролиз. Гидролиз солей
- •22, 23.Овр (окислительно-восстановительные реакции)
- •Классификация овр
- •30. Коррозия металлов
- •24. Взаимодействие металлов с водой, растворами солей, щелочей и кислот
8. Химическая кинетика
Химическая кинетика - раздел химии изучающий скорости и механизмы химических реакций.
медленная реакция- «выветривание горных пород»:
K2O • Al2O3 • 6SiO2 + CO2 + 2H2O —> K2CO3 + 4SiO2 + Al2O3 • 2SiO2 • 2H2O
полевой шпат (ортоклаз) поташ кварц каолинит
Быстрая реакция: - взрыв CH2 – O – NO2 | 2CO2 + 2H2O + N2 CH2 – O – NO2 Динитрогликоль |
Средняя скорость:
Мгновенная скорость: через lim
Скорость реакции зависит от:
|
С увеличением концентрации скорость реакции увеличивается.
Пример: разложение тиосульфата в кислой среде
a)Na2S2O3+2HCl=H2S2O3 +2NaCl; б) H2S2O3= H2O + SO2 + S¯; при С1> С2 V1 > V2
Основной закон химической кинетики – закон действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. Для реакции: aA + bB = cC
кинетическое уравнение:V = k [A]a •[B]b
k – константа скорости химической реакции, зависит от природы реагирующих веществ.
В гетерогенных реакциях скорость определяется не концентрацией, а площадью поверхности(!!!!!!!!!!), В гетерогенных реакциях твердые вещества в кинетические уравнения не включаются. Для реакции: Fe2O3 (т)+ 3CO (газ)= 2Fe (т) + 3CO2 (газ) V = k [СО]3
Увеличение давления приводит к пропорциональному росту концентрации.
10. Химическая кинетика. Катализаторы
|
Катализаторы – вещества увеличивающие скорость реакции, но к концу процесса восстанавливающие свой состав. А + В = C каталитическая реакция: стадия 1: A + Kt =AKt, стадия 2: AKt + B = AB + Kt [Н2О] - катализатор 2Al + 3J2 = 2 Al J3 -∆H Катализатор одинаково ускоряет как прямую, так и обратную реакцию и не смещает равновесие обратимого процесса.
|
9. Химическая кинетика. Температура
С увеличением температуры скорость реакции увеличивается.
П![]() равило
Вант-Гоффа: при повышении температуры
на каждые 10 градусов скорость химических
реакций возрастает в 2- 4 раза.
равило
Вант-Гоффа: при повышении температуры
на каждые 10 градусов скорость химических
реакций возрастает в 2- 4 раза.
Vt2 и Vt1 - скорости при температурах t2 и t1
g - температурный коэффициент реакции (g =2¸ 4)
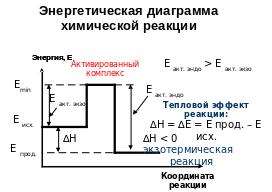
Энергия взаимодействующих частиц: Е min. – это та минимальная энергия, которой должны обладать частицы, чтобы каждое их столкновение было эффективным. Е акт. – это превышение минимально необходимой для взаимодействия энергии над средней энергией частиц в системе
Чем больше энергия активации, тем сложнее протекать реакции
Е акт. < 40 кДж/моль - реакция протекает мгновенно
Е акт. > 120 кДж/моль - реакция протекает крайне медленно
У![]() равнение
Аррениуса устанавливает зависимость
константы скорости химической
реакции
равнение
Аррениуса устанавливает зависимость
константы скорости химической
реакции
![]() от температуры
от температуры
![]() .
К – константа скорости,
Еакт - энергия активации,
.
К – константа скорости,
Еакт - энергия активации,
А – предэкспоненциальный множитель (А = р·z),
P – стерический множитель, R – универсальная газовая постоянная
Z – число столкновений в секунду в единице объема