
Пособие Гравиметрия решение задач Зарембо, Аладжаловa 2013
.pdf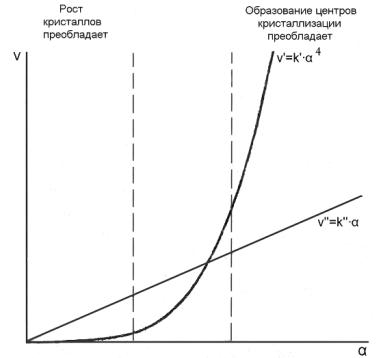
Рисунок 1 – Влияние относительного пересыщения (α) на скорость процесса осаждения (v)
С увеличением степени пересыщения α наступает момент (вправо от точки пересечения графиков), когда скорость зародышеобразования оказывается выше скорости роста кристаллов. В этом случае каждая новая порция (капля) осадителя вызывает, в основном, появление новых зародышей. В итоге получается очень мелкокристаллический осадок.
2.1Условия получения кристаллических осадков
При осаждении осаждаемая форма осадка (ОФ) должна получаться в виде удобном для отделения от раствора фильтрованием, т.е. осадок должен быть, по возможности, более крупнокристаллическим или плотным аморфным, чтобы исключить потери за счет проскока частиц через поры фильтрующего материала.
Анализ зависимости (6) показывает, что при осаждении кристаллических осадков для получения малого относительного пересыщения (α ), надо
11
создавать такие условия, при которых исходные концентрации (Q) анализируемого иона и иона-осадителя были бы минимальными, а величина растворимости (S) образующегося осадка была бы относительно большой.
Поэтому при осаждении кристаллических осадков обычно применяют следующие приемы:
1)Осаждение из разбавленных растворов для уменьшения исходных концентраций Q.
2)Осаждение из подкисленного анализируемого раствора для увеличения растворимости S в процессе осаждения.
3)Осаждение из горячего анализируемого раствора для увеличения растворимости S.
4)Медленное добавление горячего раствора осадителя при постоянном перемешивании. Низкое значение величины Q поддерживается медленным добавлением осадителя, а перемешивание предотвращает локальное повышение концентрации осадителя и локальное пересыщение.
5)Добавление избытка осадителя понижает растворимость S и способствует полному осаждению.
6)Длительное выдерживание осадка под маточным раствором. При созревании осадков происходит растворение мелких кристаллов, диффузия растворенного вещества к крупным кристаллам и осаждение на их поверхности. При этом происходит также самоочищение кристаллов – переход в раствор захваченных примесей. Время созревания обычно составляет ≈ 24 часа, но может быть снижено до 1-1,5 часов за счет нагревания полученного осадка на водяной бане.
7)Введение в промывную жидкость иона-осадителя понижает растворимость S и уменьшает потери осадка при промывании.
12
2.2 Условия получения аморфных осадков
Для осадков с очень малыми значениями константы растворимости KS0
( ПР0 ), например, для Fe(OH)3 KS0 = 6,3·10–38, для Аl(OH)3 KS0 = 1·10–32,
никакими приемами не удается получить малую степень пересыщения при осаждении. Скорость образования зародышей намного больше скорости роста кристалла (рис. 1), так как в этом случае при введении осадителя в анализируемый раствор одновременно по всему объему возникает огромное количество центров зародышеобразования, на которые затрачивается основная масса реагирующих веществ. В результате рост кристаллов прекращается до того, как они достигнут заметных размеров. Образуется микрогетерогенная система (коллоидный раствор), твердые частицы которой длительно удерживаются во взвешенном состоянии. Размер коллоидной частицы находится в диапазоне (10÷1000)·10–8 см. масса частицы около 10–19
– 10–20 г. Для быстрого осаждения и получения плотного аморфного осадка используют следующие приемы:
1)Осаждение из концентрированного анализируемого раствора, концентрированным раствором осадителя. При этом увеличивается степень относительного пересыщения α за счет повышения Q.
2)Осаждение в присутствии подходящего электролита-коагулянта (как правило соли аммония, например, NH4Cl). Его добавление способствует объединению (коагуляции) отдельных коллоидных частиц в более крупные агрегаты, которые затем легко осаждаются в виде аморфного осадка.
3)Осаждение из горячего анализируемого раствора, горячим раствором осадителя. Повышение температуры также способствует коагуляции.
13
4)Быстрое добавление раствора осадителя при непрерывном перемешивании для увеличения степени относительного пересыщения
α.
5)Сразу после осаждения добавление 100 мл горячей воды и перемешивание для уменьшения адсорбции загрязняющих веществ и получения чистых осадков.
6)Фильтрование и промывание сразу после осаждения, во избежание пептизации – разрушения агрегатов аморфного осадка и проскока частиц осадка сквозь поры фильтра.
7)Использование в качестве промывной жидкости разбавленного раствора электролита-коагулянта.
При выполнении этих условий удается получить плотные, более чистые аморфные осадки с меньшей поверхностью.
2.3Загрязнение осадков
В процессе осаждения малорастворимые соединения захватывают из раствора посторонние ионы и молекулы. Посторонние вещества попадают в осадок в результате совместного осаждения, последующего осаждения и
соосаждения.
При совместном осаждении одновременно превышается константа растворимости (произведение растворимости) осаждаемого и постороннего соединения. Отсюда понятно, что совместно осаждаться могут труднорастворимые соединения, имеющие близкие константы растворимости.
Последующее осаждение наблюдается, если осаждаемое и постороннее соединения имеют общий ион, но скорость образования осадка-примеси меньше. Тогда раствор после выпадения основного осадка остается
14
пересыщенным относительно примеси. Твердые частицы осадка могут служить центром кристаллизации для примеси, и через какое-то время происходит последующее осаждение постороннего соединения. Например, на осадке MgC2O4 происходит последующее осаждение CaC2O4·H2O. Оксалат магния проявляет склонность к образованию пересыщенного раствора вследствие его довольно высокой растворимости ( KS0 (MgC2O4 ) = 8,5·10–5).
Если раствор содержит Са+2 и Mg+2,то при добавлении оксалат-ионов, первым выпадает в осадок CaC2O4·H2O, константа растворимости которого меньше
( KS0 (СаC2O4 ) = 2,3·10–9). Выпавшие в осадок частицы CaC2O4·H2O служат
зародышами для второго осадка: на их поверхности адсорбируются оксалатионы, концентрация которых является достаточной для превышения константы растворимости MgC2O4. В результате наблюдается замедленное осаждение оксалата магния.
Для его устранения совместного и последующего осаждения посторонние ионы предварительно удаляют тем или иным способом, либо маскируют с применением комплексообразователей. Также важен правильный выбор осадителя.
Основной причиной загрязнения осадков является соосаждение. Соосаждением называется увлечение в осадок примесей, растворимых в условиях осаждения. Причинами соосаждения могут быть такие явления, как
поверхностная адсорбция, окклюзия, образование смешанных кристаллов (изоморфные включения).
Поверхностная адсорбция. Причиной адсорбции является нескомпенсированность заряда ионов на поверхности кристалла. Адсорбция
– главная причина загрязнений мелкодисперсных осадков, поскольку общая площадь их поверхности велика. Адсорбция – экзотермический процесс, поэтому повышение температуры снижает степень загрязненности осадка [6].
15
В случае образования кристаллических осадков (например, BaSO4) механизм следующий:
если сульфат бария осаждается при медленном добавлении H2SО4 к раствору BaCl2 (избыток ионов Ва+2), то из раствора на поверхности кристаллов BaSO4 будут адсорбироваться, в основном, ионы бария (сильнее притягиваются ионы осадка), образуя первичный адсорбционный слой:
BaSO4 : Ва+2,
а противоинами будут хлорид ионы, которые образуют слой противоионов: Cl–
BaSO4 : Ва+2 : Cl–.
В общем случае, в присутствии различных посторонних примесей, на осадке будут адсорбироваться преимущественно ионы с наибольшим зарядом, а при наличии в растворе нескольких одинакового заряда противоинами будут ионы, образующие наименее растворимые соединения с ионами первичного адсорбционного слоя. Например, при наличии в растворе хлорид-, нитрат-, перхлорат ионов противоинами будут преимущественно нитрат-анионы, т.к. нитрат бария менее растворим (при t = 200С: 9,2г/100г воды), чем перхлорат бария (при t = 200С: 33,8г/100г воды) или хлорид бария (при t = 200С: 35,7г/100г воды):
NO3–
BaSO4 : Ва+2 :
NO3–.
Заряд поверхности осадка, а, следовательно, и чистота осадка, зависят от того, какой ион, входящий в состав кристаллической решетки (катион или анион), находится в избытке при осаждении. Например, при медленном добавлении BaCl2 к Na2SO4 (избыток сульфат-ионов) первично адсорбированными будут ионы SO4–2, а противоионами – ионы Na+:
16
Na+
BaSO4 : SO4–2 :
Na+.
Таким образом, порядок сливания растворов в немалой степени может определить чистоту образующегося осадка.
Количество адсорбированных ионов зависит от общей поверхности осадка, поэтому осаждение следует вести в таких условиях (см. раздел 2.2), которые дают возможность получать крупнокристаллические или плотные аморфные осадки.
Окклюзия – вид соосаждения, при котором примеси захватываются растущим кристаллом. В этом случае примеси находятся внутри частиц осадка и распределены по всему осадку неравномерно. Различают адсорбционную и механическую окклюзию.
Адсорбционная окклюзия наблюдается при быстром росте кристаллов. Адсорбированные на поверхности растущего кристалла противоионы, не успевают удалиться с поверхности и обрастают следующими слоями вещества. Во избежание этого явления осаждение следует вести медленно.
Механическая окклюзия (инклюзия) – это захват некоторого количества маточного раствора внутрь кристалла вследствие несовершенства образующейся кристаллической решетки. При медленной кристаллизации инклюдированное количество маточного раствора уменьшается. В этом случае значительная доля примесей удаляется из осадка при его созревании (старении).
Например, в случае получения осадка BaSO4, при прибавлении раствора осадителя H2SО4 к раствору BaCl2 будет наблюдаться адсорбционная окклюзия значительного количества хлорид-инов (противоинов), которые не будут успевать полностью вытесняться вводимыми в раствор сульфатионами, особенно при быстром приливании раствора H2SО4. При обратном
17
сливании растворов будет наблюдаться адсорбционная окклюзия ионов водорода Н+, а не Cl–.
Таким образом, для уменьшения окклюзии посторонних катионов нужно вести осаждение так, чтобы кристаллы росли в среде, содержащей избыток собственных катионов осадка. Наоборот, для уменьшения окклюзии посторонних анионов, нужно вести осаждение в среде, содержащей избыток собственных анионов осадка.
Для уменьшения адсорбционной и механической окклюзии осаждение (смешение растворов) следует проводить медленно.
Для борьбы с окклюдированными примесями наиболее эффективным приемом является переосаждение. Для этого осадок растворяют в подходящем растворителе (например, растворе кислоты) и снова осаждают. Количество примесей в повторно осажденном осадке будет меньше.
Изоморфные включения. В ряде случаев соосаждение посторонних примесей наблюдается за счет образования смешанных кристаллов (явление изоморфизма). Изоморфными называются соединения, имеющие однотипные кристаллические решетки. Если размеры катионов (анионов) таких веществ различаются не более чем на 10-15%, то они могут замещать друг друга в кристаллической решетке.
От изоморфно-осажденных примесей освободиться промыванием не удается. Для значительного снижения количества соосаждаемой примеси требуется несколько переосаждений, что достаточно трудоемко. Хороший результат приносит изменение заряда или размера соосаждающегося иона, например комплексообразованием.
18
3 Расчеты в гравиметрическом анализе
3.1 Физические величины и соотношения между ними.
Единицы измерения физических величин
При выполнении расчетов следует использовать общепринятые обозначения физических величин и их единиц измерения. Поскольку в литературе встречаются разные символы для обозначения одних и тех же величин, ниже приводятся наименования и обозначения физических величин, принятые на кафедре аналитической химии СПбГТИ(ТУ) в соответствии с требованиями Международной системы единиц (СИ) и рекомендациями Международного Союза Теоретической и Прикладной химии (ИЮПАК).
Основными физическими величинами системы СИ, используемыми при расчетах в химических методах анализа, являются масса и количество вещества. Это две различные величины, но обе связанны с числом частиц.
• Масса вещества А (m(A)) – величина, являющаяся мерой его
инерционных и гравитационных свойств. Массу вещества определяют взвешиванием его на весах. Основная единица массы – килограмм (кг), но в расчетах обычно используют дольные единицы – граммы (г), и миллиграммы
(мг).
• Количество вещества А (n(A), моль) – величина, пропорциональная числу элементарных частиц этого вещества (атомов, молекул, ионов, эквивалентов и т.д.).
Одни элементарные частицы существуют реально (реальные частицы), например, молекула Н2, ион MnO4-. Другие – выделяют искусственно (условные частицы), например, молекула NaCl в растворе, часть молекулы
12 H2SO4 (эквивалент серной кислоты).
19

Основной единицей измерения количества вещества является моль (дольная - ммоль).
1 моль – это количество вещества, содержащее столько же реальных или условных частиц, сколько атомов содержится в 0,012 кг углерода-12, т.е. 6,02·1023.
Остальные величины, рассматриваемые ниже, являются производными, т.е. определяются через основные физические величины.
• Молярная масса вещества А (М(А), г/моль) – величина, равная массе 1
моль вещества А. Она выражается отношением массы вещества А к количеству вещества А в этой массе:
= m(A)
M (A) (7) n(A)
Значение молярной массы вещества в г/моль численно равно значению относительной молекулярной массы этого вещества – Мr(A).
Мr(A) – безразмерная величина, численно равная сумме относительных атомных масс (Аr) всех атомов, входящих в состав молекулы данного вещества А. Относительные атомные массы химических элементов приведены в Периодической системе элементов Д.И. Менделеева. Чтобы не
допускать арифметических ошибок в расчете молярной массы, студентам рекомендуется пользоваться справочной таблицей молярных масс различных веществ, приведенной в [5].
Из уравнения (1) следует, что количество вещества связано с массой этого вещества соотношением:
= m(A)
n(A) (8)
M (A)
20
