
Пособие Гравиметрия решение задач Зарембо, Аладжаловa 2013
.pdf
тогда: |
|
|
|
|
|
|
|
|
|
0 |
|
2,3 10−9 |
|
|
S = |
KS (СаС2О4 ) |
= |
=7,3 10−5 моль/л. |
||
|
|
0,66 0,66 |
||||
|
|
|
γM γA |
|
||
Следовательно, растворимость осадка в 0,01М растворе КNO3 увеличилась |
||||||
в |
7,3 10−5 |
=1,5 раза. |
|
|
||
4,8 10−5 |
|
|
||||
|
|
|
|
|
||
Ответ: |
|
растворимость в воде 4,8 10−5 моль/л, |
||||
|
|
|
растворимость с учетом солевого эффекта 7,3 10−5 моль/л. |
|||
Пример 27. Вычислить растворимость сульфата бария (BaSO4) в 0,1М растворе сульфата натрия с учётом и без учёта влияния ионной силы раствора. Сравнить с растворимостью в воде. Для BaSO4 ПРº = 1,1·10-10.
Решение:
В этом случае на растворимость осадка BaSO4 влияют два фактора: ионная сила раствора Na2SO4 и одноименный ион SO4−2 .
1)расчет растворимости в воде по формуле (22):
Для BaSO4: p = 1, q = 1.
S = K |
S |
0 (BaSО ) = 1,1 10−10 |
=1,05 10−5 моль/л. |
|
4 |
|
2)расчет растворимости с учетом только избыточной концентрации одноименного иона SO4−2 по формуле (28):
S = |
K O (BaSO ) |
= |
1,1 10−10 |
=1,1 10-9 |
моль/л. |
||
S |
4 |
|
|
||||
|
C |
0,1 |
|||||
|
|
|
|
|
|||
Na2SO4
61

Растворимость уменьшилась в 1,05 10−5 =9,5 103 раз. 1,1 10−9
3)расчет растворимости с учетом только ионной силы по формуле (21):
|
K0 |
(BaSО4 ) |
|
S = |
S |
|
|
γBa+2 γSO −2 |
|||
|
|||
|
|
4 |
|
Ионную силу 0,1М раствора Na2SO4 можно рассчитать по формуле (4):
I= 12 ∑(ci zi2 )
Врастворе: Na2SO4 →2 Na+ + SO4−2 ,
отсюда:
С(Na+) = 2 0,1моль/л, С(SO4−2 ) =0,1моль/л.
тогда:
I = 12 (c(Na+) z2 (Na+) +c(SO4−2 ) z2 (SO4−2 )) = = 12 (2 0,1 12 +0,1 22 ) =0,3.
По справочной таблице [5] для I = 0,3:
γ(Ва2+) = 0,25,
γ( SO4−2 ) =0,25,
Тогда:
62

|
0 |
(BaSО4 ) |
|
1,1 10−10 |
|
S = |
KS |
= |
= 4,2 10−5 моль/л. |
||
|
|
0,25 0,25 |
|||
|
γBa+2 γSO −2 |
|
|||
|
|
4 |
|
|
|
В этом случае по сравнению с водой растворимость увеличилась в
4,2 10−5 |
= 4 раза. |
|
1,05 10−5 |
||
|
4) Расчет растворимости с учетом ионной силы и одноименного иона по формуле (28):
S = |
K |
S |
(BaSO ) |
= |
K 0 |
(BaSO ) |
|
= |
|
|
|||||||
|
|
4 |
|
S |
|
|
4 |
|
|
|
|||||||
|
|
C |
|
C |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
γ |
Ba |
+2 γSO |
|
|
|||||
|
|
|
|
Na SO |
|
|
Na SO |
|
|
4 |
|
|
|
||||
|
|
|
|
2 |
4 |
|
|
2 |
4 |
|
|
|
|
|
|
|
|
= |
|
1,1 10−10 |
|
=1,8 10-8моль/л. |
|
|
|
|
|||||||||
0,1 0, 25 0, 25 |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
В этом |
|
случае |
|
растворимость |
увеличилась по |
сравнению с |
|||||||||||
растворимостью под влиянием только одноименного иона в |
1,8 10−8 |
=16,4 |
|||||||||||||||
1,1 10−9 |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
раза, что говорит о влиянии ионной силы раствора.
Следовательно, наибольшее влияние на растворимость осадка оказывает введение в его насыщенный раствор одноименного иона.
3.4Влияние конкурирующих реакций на растворимость осадков
Ионы осадка в насыщенном растворе могут вступать в реакции с компонентами раствора, образуя малодиссоциированные растворимые соединения (слабые кислоты или основания) или комплексы.
Анион осадка (анион слабой кислоты) взаимодействует с протоном Н+, а катион образует комплексные соединения с лигандом L по схеме (для простоты заряды ионов опущены):
63

MA R M |
+ |
A |
+ |
|
+ |
L |
|
H + |
↑↓ |
|
↑↓ |
ML, ML2, …, МLn |
|
HA, H2A, …, HmA |
Наличие конкурирующих реакций всегда ведет к повышению растворимости, так как при уменьшении концентрации свободных ионов осадка, равновесие реакции (1) сдвигается вправо в сторону раствора.
Как было отмечено в разделе 1 в случае протекания конкурирующих реакций равновесие в системе осадок – раствор описывается условной константой растворимости KS′ (условным произведеним растворимости
ПP′ ). Связь KS′ |
и KS0 показывает формула (5): |
|||||||
|
p |
|
q |
|
|
K0 |
|
|
KS′ |
|
|
|
|
γS p |
|
||
=CM |
CA |
= |
α p |
αq |
γq |
|||
|
|
|
|
|
M |
A |
M |
A |
где CM = [M] + [ML] + [ML2] + …+ [MLn],
CA = [A] + [HA] + [H2A] + [HmA] – соответственно, суммарные равновесные концентрации всех возможных форм ионов М и А в растворе (заряды ионов для простоты написания опущены).
За счёт протекания конкурирующих реакций равновесные концентрации свободных ионов М и А уменьшаются и составят лишь долю (молярную долю – α) от их суммарных концентраций:
αM |
= |
[M ] |
[M ] =αM CM , |
|
|
|
CM |
|
|
αA |
= |
[A] |
[A] =αA CA . |
(36) |
|
|
CA |
|
|
|
|
|
|
64 |
В отсутствие конкурирующих реакций αM и αA равны 1, а в случае их протекания αM и αA меньше 1. Обычно изменение растворимости за счёт побочных реакций значительно больше, чем из-за электростатических взаимодействий, поэтому при расчете растворимости с учетом протекания конкурирующих реакций пренебрегают влиянием ионной силы раствора. Поэтому принимают γМ = γА = 1.
3.4.1 Расчет растворимости осадков с учетом протолитических реакций их ионов (влияние рН)
Если осадок MpAq образован анионом слабой кислоты, протолитическая реакция идет под действием сильной кислоты по схеме:
Ap – + H3O + R HA(p-1) – + H2O
HA(p-1) – + H3O + R H2A(p-2) – + H2O
ит.д.
Врезультате протолиза концентрация свободных анионов в растворе уменьшается, равновесие (1) сдвигается вправо в сторону раствора, происходит растворение осадка (растворимость осадка увеличивается).
Равновесные концентрации ионов можно выразить через растворимость осадка (S) следующим образом:
[M ] = р S
[A] =q S αА
Концентрационную константу растворимости малорастворимого соединения MpAq, анион которого подвергается протолизу, можно записать в виде:
65
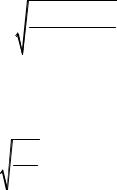
KS =[M ]p [A]q =( p S)p (q S αA )q = p p qq αAq S p+q .
Отсюда:
S = p+q |
KS |
|
p p qq αAq . |
(37) |
Для бинарных соединений (p = q = 1)
S = KS . (38)
α
A
Для расчёта αA необходимо знать концентрацию ионов Н+ (рН) и
ступенчатые константы ионизации ( Kai ) кислоты, анион которой входит в
состав осадка и подвергается протолизу. Для 3-х основной кислоты:
αA3− = |
|
|
|
|
Ka Ka |
Ka |
|
|
|
|
|
|
|
|
1 |
2 |
3 |
|
. |
(39) |
|
Ka |
Ka |
Ka |
+ Ka |
Ka |
[H + ] + Ka |
[H + ]2 +[H + ]3 |
||||
1 |
2 |
3 |
1 |
2 |
|
1 |
|
|
||
Для 2-х основной кислоты:
αA2− = |
|
|
Ka |
Ka |
|
|
|
|
1 |
2 |
. |
(40) |
|
Ka |
Ka |
+ Ka |
[H + ] +[H + ]2 |
|||
1 |
2 |
1 |
|
|
|
|
Для одноосновной кислоты:
αA− = |
Ka |
|
|
|
. |
(41) |
|
Ka +[H + ] |
|||
Пример 28. Рассчитать растворимость |
CaC2O4 в его насыщенном |
||
растворе при рН = 3,0 и сравнить с растворимостью в воде.
66

Для СаС2О4: KoS = 2,3·10–9;
Для щавелевой кислоты (Н2С2О4): Kа1 = 5,6·10–2; Kа2 = 5,4·10–5.
Решение:
Среда кислая (рН = 3,0), следовательно, в растворе проходит протолиз оксалат-ионов:
С2О4−2 +Н3О+ R НС2О4− +Н2О НС2О4− +Н3О+ R Н2С2О4 +Н2О
1) Расчет растворимости при рН = 3,0. |
|
|
Влиянием ионной силы |
раствора можно |
пренебречь, поэтому |
K S (CaC2O4 ) = KS0 (CaC2O4 ) . |
Растворимость осадка |
можно рассчитать по |
формуле (38): |
|
|
S = KS (СаС2O4 ) .
α
С2O4−2
Молярную долю свободных (непротонированных) оксалат-ионов можно рассчитать по формуле (40) для двухосновной кислоты:
αС О |
2− = |
|
|
Ka |
Ka |
|
|
|
|
|
|
1 |
2 |
|
|
|
|||
Ka |
Ka |
+ Ka |
[H |
+ |
] +[H |
+ 2 |
|||
2 |
4 |
|
|
] |
|||||
|
|
|
|
|
|
|
|
||
|
|
|
1 |
2 |
1 |
|
|
|
|
Молярную концентрацию ионов [Н+] можно рассчитать по заданной величине рН:
pH = −lg[H + ] = 3,0 [H + ] =10−3 моль/л .
Тогда:
67

αC O |
2− = |
|
|
|
5,6 10−2 5,4 10−5 |
|
|
|
|
|
=0,05. |
|||||
5,6 10 |
−2 |
5,4 10 |
−5 |
+5,6 10 |
−2 |
10 |
−3 |
+(10 |
−3 |
) |
2 |
|||||
2 |
4 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
S = |
|
2,3 10−9 |
= 2,1 10−4 |
моль/л. |
|
|
|
|
|
|
|
|
||||
|
|
0,05 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2)Расчет растворимости в воде.
Растворимость в воде для бинарного соединения по формуле (22) составит:
S = 2,3 10−9 = 4,8 10−5 моль/л. |
|
|
||
Растворимость в кислоте больше в |
2,1 |
10−4 |
= 4,4 раза, чем в воде. |
|
4,8 |
10−5 |
|||
|
|
|||
Пример 29. Вычислить растворимость сульфата бария: а) в воде; б) в 0,1М растворе HCl (учесть влияние pH). Будет ли достигнуто полное
осаждение в этих условиях? Для BaSO4 |
K |
0 |
= 1,1·10–10. Константа |
|
|
S |
|
диссоциации H2SO4 К2 = 1,2·10–2. |
|
|
|
Решение:
1) Расчет растворимости в воде.
Растворимость в воде для бинарного соединения по формуле (22) составит:
S = 1,1 10−10 =1,05 10−5 моль/л.
Расчет растворимости в кислоте может быть проведен по формуле (38):
S= KS (ВаSO4 )
αSO4−2
68

Если пренебречь влиянием на растворимость ионной силы раствора, то
K S (ВаSO4 ) = KS0 (BaSO4 ) =1,1 10−10 .
Молярную долю непротонированных сульфат-ионов можно рассчитать по формуле (41), т.к. серная кислота диссоциирует нацело по одной ступени:
αSO4−2 |
= |
|
K |
2 |
|
|
= |
|
1, 2 10−2 |
|
=1,1 10−1 |
моль/л , |
||
K2 |
+[H |
+ |
] |
1, 2 10 |
−2 |
+0,1 |
||||||||
|
|
|
|
|
|
|
||||||||
Тогда:
S = |
K |
S |
(ВаSO ) |
= |
|
K |
0 (ВаSO ) |
= |
1,1 10−10 |
= 3, 2 10−5 моль/л |
||||||||
|
|
4 |
|
|
S |
|
4 |
|
|
|
|
|
||||||
|
|
αSO −2 |
|
|
|
αSO −2 |
|
|
|
|
|
1,1 10−1 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
4 |
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
Растворимость ВаSO4 |
в кислоте в |
|
|
3,2 10−5 |
=3,1 раза больше, чем в воде. |
|||||||||||||
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
1,05 10−5 |
|
|
||||||
Растворимость |
в |
|
кислоте |
превышает |
допустимую растворимость |
|||||||||||||
( 3, 2 10−5 моль/л |
> |
|
10−6 моль/л), |
|
условие |
полного осаждения (35) не |
||||||||||||
выполняется. Следовательно, в этих условиях полное осаждение не достигнуто.
Пример 30. Вычислить, достигается ли практически полное осаждение ионов кальция раствором (NH4)2C2O4 , если осаждение ведут при рН = 2? Для
CaC2O4 KS0 = 2,3·10–9. Ступенчатые константы диссоциации щавелевой кислоты (H2C2O4): К1 = 5,6·10–2 и К2 = 5,4·10–5.
Решение:
Условие полного осаждения по (35):
Sдоп. ≤ 10–6моль/л.
69

Если |
пренебречь |
влиянием |
ионной |
силы, |
то |
K S (CaC2O4 ) = KS0 (CaC2O4 ) = 2,3 10−9 . Тогда растворимость осадка можно рассчитать по формуле (38):
S = |
K |
S |
(CaC O ) |
= |
K 0 |
(CaC O ) |
|||
|
|
2 4 |
S |
|
2 4 |
|
|||
|
|
αC O −2 |
|
|
. |
||||
|
|
|
|
|
|
||||
|
|
|
|
|
αC O −2 |
||||
|
|
|
2 |
4 |
|
|
2 |
4 |
|
Среда кислая (рН = 2), следовательно, в растворе проходит протолиз оксалатионов:
С2О4−2 +Н3О+ R НС2О4− +Н2О НС2О4− +Н3О+ R Н2С2О4 +Н2О
Молярную долю свободных (непротонированных) оксалат-ионов можно рассчитать по формуле (40) для двухосновной кислоты:
αС О |
2− = |
|
|
Ka |
Ka |
|
|
|
|
|
|
1 |
2 |
|
|
|
|||
Ka |
Ka |
+ Ka |
[H |
+ |
] +[H |
+ 2 |
|||
2 |
4 |
|
|
] |
|||||
|
|
|
|
|
|
|
|
||
|
|
|
1 |
2 |
1 |
|
|
|
|
Молярную концентрацию ионов [Н+] можно рассчитать по заданной величине рН:
pH = −lg[H + ] = 2 [H + ] =10−2 моль/л.
Тогда: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
αC O |
2− = |
|
|
|
5,6 10−2 5,4 10−5 |
|
|
|
|
|
= 4,6 10 |
−3 |
. |
||||||
5,6 10 |
−2 |
5,4 10 |
−5 |
+5,6 |
10 |
−2 |
10 |
−2 |
+(10 |
−2 |
) |
2 |
|
||||||
2 |
4 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
S = |
|
2,3 10−9 |
=7 10−4 моль/л. |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
4,6 10−3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70
