
- •Принцип независимости действия сил
- •Абсолютно упругий и неупругий удар
- •1)Идеальный газ
- •Классический идеальный газ
- •Квантовый идеальный газ
- •Ферми-газ
- •Бозе-газ
- •Электростатическая индукция в проводниках
- •Электростатическая индукция в диэлектриках
- •Плотность зарядов (линейная поверхностная, объемная)
- •Другие определения
- •[Править]Теплоёмкость для различных состояний вещества
- •[Править]Теория теплоёмкости
- •Майера уравнение
- •Теория теплоёмкости Эйнштейна
- •[Править]Недостатки теории
- •Модель Дебая
- •История
- •Физический смысл адиабатического процесса Работа газа
- •[Править]Внутренняя энергия идеального газа
- •[Править]Адиабатический процесс
- •[Править]Энтропия и обратимость
- •Уравнение Пуассона для идеального газа [править]Адиабата Пуассона
- •[Править]Вывод уравнения
- •Описание цикла Карно
- •[Править]кпд тепловой машины Карно
- •[Править]Связь между обратимостью цикла и кпд
- •Формулировки
- •[Править]Ограничения
- •[Править]Второе начало термодинамики и «тепловая смерть Вселенной»
- •[Править]Энтропия и критика эволюционизма
- •Общее описание
- •[Править]Уравнения Фика
- •[Править]Геометрическое описание уравнения Фика
- •Закон теплопроводности Фурье
- •[Править]Коэффициент теплопроводности вакуума
- •[Править]Связь с электропроводностью
- •[Править]Коэффициент теплопроводности газов
- •[Править]Обобщения закона Фурье
- •Сила вязкого трения
- •[Править]Вторая вязкость
- •[Править]Вязкость газов
- •[Править]Влияние температуры на вязкость газов
- •Вязкость жидкостей [править]Динамический коэффициент вязкости
- •[Править]Кинематическая вязкость
- •[Править]Ньютоновские и неньютоновские жидкости
- •[Править]Вязкость аморфных материалов
- •[Править]Физика реального газа
- •Уравнение состояния
- •Внутренняя энергия газа Ван-дер-Ваальса
- •Критические параметры
- •Приведённые параметры
- •Недостатки уравнения Ван-дер-Ваальса
- •Коэффициент k
- •[Править]Закон Кулона в квантовой механике
- •[Править]Закон Кулона с точки зрения квантовой электродинамики
- •[Править]История
- •[Править]Закон Кулона, принцип суперпозиции и уравнения Максвелла
- •[Править]Cтепень точности закона Кулона
- •[Править]Поправки к закону Кулона в квантовой электродинамике
- •[Править]Закон Кулона и поляризация вакуума
- •[Править]Закон Кулона и сверхтяжелые ядра
- •[Править]Значение закона Кулона в истории науки
- •Лектрический заряд, напряжение, потенциал
- •[Править]Принцип суперпозиции в электродинамике
- •[Править]Примеры нарушения электродинамического принципа суперпозиции
- •[Править]Отсутствие принципа суперпозиции в нелинейных теориях
- •Поток вектора напряженности электрического поля. Теорема Гаусса
- •Теорема Остроградского—Гаусса и ее применение для расчета электростатических полей
- •Равномерно заряженная бесконечная плоскость
- •Бесконечная равномерно заряженная нить
- •Разность потенциалов
- •32 Диэлектрики в электрическом поле. Вектор поляризации. Диэлектрическая восприимчивость вещества. Диэлектрическая проницаемость. Электрическое смещение.
- •Типы поляризации
- •[Править]Зависимость вектора поляризации от внешнего поля [править]в постоянном поле [править]в слабых полях
- •[Править]в сильных полях
- •[Править]в зависящем от времени поле
- •Зависимость от времени
- •[Править]Тензор поляризуемости
- •Практическое применение
- •[Править]Зависимость от частоты
- •Электроемкость. Конденсаторы
- •Проводники электричества
- •Электрические изоляторы
- •Гальванические элементы
- •Закон Ома для неоднородного участка цепи
Уравнение состояния
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом итемпературой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]()
где
p — давление,
V — молярный объём,
T — абсолютная температура,
R — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
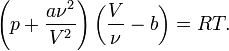
где
V — объём,
Внутренняя энергия газа Ван-дер-Ваальса
Потенциальная энергия межмолекулярных сил взаимодействия вычисляется как работа, которую совершают эти силы, при разведении молекул на бесконечность:

Внутренняя энергия газа Ван-дер-Ваальса складывается из его кинетической энергии (энергии теплового движения молекул) и только что нами посчитанной потенциальной. Так, для одного моль газа:
![]()
где — молярная теплоёмкость при постоянном объёме, которая предполагается не зависящей от температуры.
Критические параметры
Критическими параметрами газа называются значения его макропараметров (давления, объёма и температуры) в критической точке, т.е. в таком состоянии, когда жидкая и газообразная фазы вещества неразличимы. Найдем эти параметры для газа Ван-дер-Ваальса, для чего преобразуем уравнение состояния:
![]()

Мы получили уравнение третьей степени относительно .

В критической точке все три корня уравнения сливаются в один, поэтому предыдущее уравнение эквивалентно следующему:
![]()
![]()
Приравняв коэффициенты при соответствующих степенях , получим равенства:
![]()
![]()
![]()
Из них вычислим значения критических параметров...
![]()
![]()
![]()
...и критического коэффициента:
![]()
Приведённые параметры
Приведённые параметры определяются как отношения
![]()
Если
подставить в уравнение
Ван-дер-Ваальса ![]() получится
приведённое уравнение состояния.
получится
приведённое уравнение состояния.

Стоит отметить, что если вещества обладают двумя одинаковыми приведёнными параметрами из трёх, то и третьи приведённые параметры у них совпадают.
Недостатки уравнения Ван-дер-Ваальса
1. Для
реальных веществ ![]()
2. Для
реальных веществ ![]() (скорее,
(скорее, ![]() )
)
3. Уравнение Ван-дер-Ваальса расходится с экспериментом в области двухфазных состояний.
28 Критическое состояние вещества. Фазовые периоды I и II рода. Особенности жидкого, твердого, газообразного состояний.
Критическое состояние вещества |
|
|
|
Ненасыщенный пар ведет себя почти так же, как и обычный газ. В частности, при постоянной температуре, он почти подчиняется закону Бойля–Мариотта.
Однако, при сжатии воздуха, содержащего ненасыщенный пар, концентрация последнего будет расти и он когда-то достигнет состояния насыщения.
При дальнейшем сжатии часть пара начнет конденсироваться, а давление будет оставаться равным давлению насыщенного пара.
Наконец, весь пар сконденсируется и дальнейшее сжатие, теперь уже не пара, а жидкости, приводящее к заметному изменению объема, потребует увеличения давления на несколько порядков величины.
|
В то же время, из-за теплового расширения жидкости, полная конденсация пара произойдет при большем объеме, чем в первом случае.
Если эти рассуждения верны, то следует ожидать, что должна существовать некая критическая температура, выше которой невозможно образование насыщенного пара.
|
Пронаблюдать переход вещества через критическую точку можно на опыте. В запаянную ампулу, находящуюся внутри металлического кожуха, налит эфир. Над эфиром находятся его насыщающие пары. Чтобы лучше рассмотреть протекающий процесс, изображение ампулы надо спроецировать на экран.
|
Граница между жидкостью и паром размывается и, наконец, исчезает. При дальнейшем нагревании весь эфир в ампуле находится в газообразном состоянии. Перестанем подогревать ампулу. Пар охлаждается и при некоторой температуре происходит его конденсация во всем объеме ампулы. Появляется плотный туман, заполняющий весь сосуд, и вновь возникает граница раздела жидкости и насыщающего пара.
Фазовые переходы первого и второго рода
Понятие фазы. Фазовые переходы первого рода. Фазовые
переходы второго рода. Низкотемпературные и высокотемпературные
сверхпроводники. Двухжидкостная модель сверхпроводника.
Притяжение между электронами. Куперовские пары. Теория БКШ.
Квантовые эффекты, связанные с сверхпроводимостью.
Сверхпроводники в магнитном поле. Эффект Мейсснера. Критическое
поле. «Гроб Магомета». Сохранение магнитного потока. Эффект
Джозефсона. Квантование магнитного потока. Применение
сверхпроводников. Сверхтекучесть. Бозе-эйнштейновская
конденсация. Природа ферромагнетизма. Точка Кюри. Процесс
намагничения ферромагнетиков.
Фазовые переходы первого рода
Введем понятие фазы. Фаза – физически однородная часть вещества,
отделенная от других частей системы границей раздела.
Фазовые переходы первого рода (плавление, кристаллизация,
испарение, конденсация, сублимация) сопровождаются теплотой перехода.
Теплота перехода – количество теплоты, которое необходимо сообщить
веществу, чтобы изотермически – изобарически перевести его из одной фазы
в другую.
Фазовые переходы II рода происходят без поглощения или выделения
тепла или изменения удельного объема.
Как известно, вещество в жидком состоянии сохраняет свой объем, но принимает форму сосуда, в котором оно находится. Сохранение объема жидкости объясняется наличием сил притяжения между молекулами. Эти силы межмолекулярного взаимодействия удерживают молекулу жидкости около её временного положения равновесия примерно в течение 10-11 с, после чего она перескакивает в новое временное положение равновесия приблизительно на расстоянии своего диаметра. Время между двумя перескоками молекулы из одного положения равновесия в другое называется временем оседлой жизни. Это время зависит от вида жидкости и температуры. При нагревании среднее время оседлой жизни уменьшается. Благодаря возможности довольно свободного перемещения молекул относительно друг друга жидкости обладают текучестью, поэтому они не имеют постоянной формы, а принимают форму сосуда. Если выделить в жидкости очень малый объем, то в течение времени оседлой жизни в нем существует упорядоченное расположение молекул, как бы зародыш кристаллической решетки. Затем это расположение распадается, но возникает в другом месте. Поэтому принято говорить, что в жидкости существует ближний порядок в расположении молекул, но отсутствует дальний порядок. Жидкости проявляют ряд механических свойств, сближающих их в большей мере с твердыми телами, чем с газами. К ним можно отнести упругость (при кратковременном воздействии), хрупкость (т.е. способность к разрыву), низкая сжимаемость. Еще одно существенное отличие от газов: в газах кинетическая энергия молекул значительно больше их потенциальной энергии, тогда как в жидкостях потенциальная и кинетическая энергии примерно равны.
ГА́З (франц. gaz, от греч. chaos — хаос), агрегатное состояние вещества, в котором составляющие его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения.
Газообразное состояние вещества является самым распространенным состоянием вещества Вселенной. Солнце, звезды, облака межзвездного вещества, туманности, атмосферы планет и т. д. состоят из газов, или нейтральных, или ионизованных (плазмы). Газы широко распространены в природе: они образуют атмосферу Земли, в значительных количествах содержатся в твердых земных породах, растворены в воде океанов, морей и рек. Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов.
Газы равномерно заполняют доступное для них пространство, и в отличие от жидкостей и твердых тел, не образуют свободной поверхности. Они оказывают давление на ограничивающую заполняемое ими пространство оболочку. Плотность газов при нормальном давлении на насколько порядков меньше плотности жидкостей. В отличие от твердых тел и жидкостей, объем газов существенно зависит от давления и температуры.
Свойства большинства газов — прозрачность, бесцветность и легкость — затрудняло их изучение, поэтому физика и химия газов развивались медленно. Только в 17 в. было доказано, что воздух обладает весом (Э. Торричелли и Б. Паскаль). Тогда же Я. ван Гельмонт ввел термин газы для обозначения воздухоподобных веществ. И только к середине 19 в. были установлены основные закономерности, которым подчиняются газы. К ним относятся закон Бойля — Мариотта, закон Шарля, закон Гей-Люссака, закон Авогадро.
Наиболее полно изучены были свойства достаточно разряженных газов, в которых расстояния между молекулами при нормальных условиях порядка 10 нм, что значительно больше радиуса действия сил межмолекулярного взаимодействия. Такой газ, молекулы которого рассматриваются как невзаимодействующие материальные точки, называется идеальным газом. Идеальные газы строго подчиняются законам Бойля — Мариотта и Гей-Люссака. Практически все газы ведут себя как идеальные при не слишком высоких давлениях и не слишком низких температурах.
Уравнение pV=RT называют уравнением состояния идеального газа. Оно было получено в 1834 Б. Клапейроном и обобщено Д. И. Менделеевым для любой массы газа. Входящая в это уравнение газовая постоянная R равна 8,31 Дж/моль.град. Уравнение Клапейрона — Менделеева справедливо только для идеальных газов. Для них выполняется такжезакон Дальтона.
Твёрдое тело — это агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов, которые совершают малые колебания около положений равновесия. Различают кристаллические и аморфные твердые тела (см.дальний и ближний порядок). Кристаллы характеризуются пространственною периодичностью в расположении равновесных положений атомов. В аморфных телах атомы колеблются вокруг хаотически расположенных точек. Согласно классическим представлениям, устойчивым состоянием (с минимумом потенциальной энергии) твёрдого тела является кристаллическое. Аморфное тело находится вметастабильном состоянии и с течением времени должно перейти в кристаллическое состояние, однако время кристаллизации часто столь велико, что метастабильность вовсе не проявляется.
Атомы и молекулы, составляющие твёрдое тело, плотно упакованы вместе. Другими словами, молекулы твёрдого тела практически сохраняют своё взаимное положение относительно других молекул[1] и удерживаются между собой межмолекулярным взаимодействием.
Многие твёрдые тела содержат в себе кристаллические структуры. В минералогии и кристаллографии под кристаллической структурой подразумевается определённый порядок атомов в кристалле. Кристаллическая структура состоит из элементарных ячеек, набора атомов расположенных в особенном порядке, который периодически повторяется во всех направлениях пространственной решётки. Расстояния между элементами этой решётки в различных направлениях называют параметром этой решётки. Кристаллическая структура и симметричность играют роль в определении множества свойств, таких как спайность кристалла, электронная зонная структура и оптические свойства.
При применении достаточной силы любое из этих свойств может быть нарушено, вызывая остаточную деформацию.
Твёрдые тела обладают тепловой энергией, следовательно их атомы совершают колебательное движение. Тем не менее это движение незначительно и не может наблюдаться или быть почувствованным при нормальных условиях.
Раздел физики, изучающий твёрдые тела называется физикой твёрдого тела и является подразделом физики конденсированных сред. Материаловедение главным образом рассматривает вопросы, связанные со свойствами твёрдых тел, такими как твёрдость, предел прочности, сопротивление материала нагрузкам, а также фазовые превращения. Это значительным образом совпадает с вопросами, изучаемыми физикой твёрдого тела. Химия твёрдого состояния перекрывает вопросы, рассматриваемые обоими этими разделами знаний, но особенно затрагивает вопросы синтезирования новых материалов.
Легчайшим известным твёрдым материалом является аэрогель. Некоторые виды аэрогеля имеют плотность 1.9 мг/см³ или 1.9 кг/м³ (1/530 плотности воды).
29 Закон Кулона. Электрический заряд и напряженность электрического поля. Принцип суперпозиции. Электрический диполь.
Зако́н Куло́на — это закон о взаимодействии точечных электрических зарядов.
Был открыт Шарлем Кулоном в 1785 г. Проведя большое количество опытов с металлическими шариками, Шарль Кулон дал такую формулировку закона:
Модуль силы взаимодействия двух точечных зарядов в вакууме прямо пропорционален произведению модулей этих зарядов и обратно пропорционален квадрату расстояния между ними
Иначе: Два точечных заряда в вакууме действуют друг на друга с силами, которые пропорциональны произведению модулей этих зарядов, обратно пропорциональны квадрату расстояния между ними и направлены вдоль прямой, соединяющей эти заряды. Эти силы называются электростатическими (кулоновскими).
Важно отметить, что для того, чтобы закон был верен, необходимы:
точечность зарядов — то есть расстояние между заряженными телами много больше их размеров — впрочем, можно доказать, что сила взаимодействия двух объёмно распределённых зарядов со сферически симметричными непересекающимися пространственными распределениями равна силе взаимодействия двух эквивалентных точечных зарядов, размещённых в центрах сферической симметрии;
их неподвижность. Иначе вступают в силу дополнительные эффекты: магнитное поле движущегося заряда и соответствующая ему дополнительная сила Лоренца, действующая на другой движущийся заряд;
взаимодействие в вакууме.
Однако с некоторыми корректировками закон справедлив также для взаимодействий зарядов в среде и для движущихся зарядов.[1]
В векторном виде в формулировке Ш. Кулона закон записывается следующим образом:
![]()
где ![]() —
сила, с которой заряд 1 действует на
заряд 2; q1,q2 —
величина зарядов;
—
сила, с которой заряд 1 действует на
заряд 2; q1,q2 —
величина зарядов; ![]() —
радиус-вектор (вектор, направленный от
заряда 1 к заряду 2, и равный, по модулю,
расстоянию между зарядами — r12); k —
коэффициент пропорциональности. Таким
образом, закон указывает, что одноимённые
заряды отталкиваются (а разноимённые —
притягиваются).
—
радиус-вектор (вектор, направленный от
заряда 1 к заряду 2, и равный, по модулю,
расстоянию между зарядами — r12); k —
коэффициент пропорциональности. Таким
образом, закон указывает, что одноимённые
заряды отталкиваются (а разноимённые —
притягиваются).


