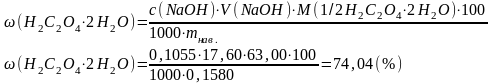- •Глава 1. Основні положення титриметричного аналізу
- •Вимоги до реакцій у титриметричному аналізі
- •Класифікація методів титриметрії в залежності від типу реакції
- •Класифікація методів титриметрії за способом титрування
- •Способи приготування стандартних розчинів
- •1. Приготування первинних стандартних розчинів
- •2. Приготування вторинних стандартних розчинів
- •3. Приготування стандартних розчинів із фіксаналів
- •Глава 2. Розрахунки в титриметричному аналізі
- •2.1. Способи виразу концентрації речовин у розчинах у титриметрії
- •Глава 3. Метод кислотно–основного титрування Теоретичні основи
- •Індикатори методу кислотно-основного титрування
- •Показник індикаторів рК, показник титрування рН
- •Класифікація індикаторів
- •Криві титрування
- •1. Титрування сильних кислот сильними основами (Рис 1.)
- •2.Титрування слабких основ сильними кислотами. (Рис 2.)
- •3. Титрування слабких кислот сильними основами.(Рис 3.)
- •4. Титрування слабких кислот слабкими основами. (Рис. 4)
- •5. Титрування багатоосновних кислот (Рис 5.)
- •Кислотно-основне титрування в неводних середовищах
- •Робочі розчини у методах неводного титрування
- •Практичне використання методів кислотно-основного титрування в аналізі фармацевтичних препаратів
- •Практична робота способи виразу вмісту речовин у розчинах
- •Приклади розв’язання задач
- •Практична робота розрахунок результатів аналізу в титриметрії
- •Приклади розв'язання задач
- •Використаний аналітичний прийом – метод піпетування.
- •Розв’язання задачі
- •Використаний прийом – метод окремих наважок.
- •Розв’язання задачі
- •Лабораторна робота приготування та стандартизація титранту натрій гідроксиду
- •Хімізм процесу
- •План експерименту
- •Висновок
Розв’язання задачі
Дано: |
Рішення: |
mнав.(H2C2O4·2Н2О)= 1,7020 г Vм.к. = 250,00 см3 Vп. = 20,00 см3 V(NaOH) = 19,50 см3 с(NaOH)= 0,1 моль/дм3 К = 1,006 |
Хімізм: Н2С2О4 + 2NaOH → Na2С2О4 + 2Н2О З рівняння реакції вибігає, що:
Задачу можна вирішити, підставляючи вихідні дані у загальну формулу:
|
ω(Н2С2О4·2Н2О) – ? |
|
|
Відповідь: ω(Н2С2О4·2Н2О) = 90,78 % |
Приклад 4. Наважка технічної оксалатної кислоти масою 0,1580 г розчинена в довільному об’ємі води і повністю відтитрована стандартним розчином лугу, концентрація якого становить 0,1055 моль/дм3. Об’єм титранту, який пішов на титрування дорівнює 17,60 см3. Визначити масову частку Н2С2О4·2Н2О в досліджуваному продукті.
Використаний прийом – метод окремих наважок.
Алгоритм розв’язання задачі у загальному вигляді:
1. Згідно закону еквівалентів:
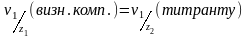
2. Кількість молей-еквіваленту титранту в об’ємі V(Т), який пішов на титрування:
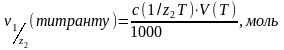 (1)
(1)
3. Тоді:
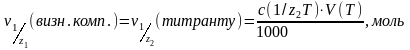 (2)
(2)
4. Маса визначаємого компоненту:
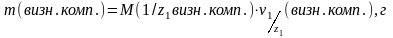
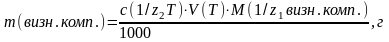 (3)
(3)
5. Масова частка (ω) основного компоненту в досліджуваній речовині, тобто у вихідній наважці mнав.:
-
mнав.
-
100 %
m(визн.комп.)
-
ω
(4)
Для виведення загальної формули послідовно підставити в формулу (4) необхідні значення з формули (3):
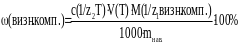
Розв’язання задачі
Дано: |
Рішення: |
mнав.(H2C2O4·2Н2О)= 0,1580 г V(NaOH) = 17,60 см3
|
Хімізм: Н2С2О4 + 2NaOH → Na2С2О4 + 2Н2О З рівняння реакції вибігає, що:
Загальна формула для визначення масової частки Н2С2О4·2Н2О в досліджуваному продукті (метод окремих наважок):
|
ω(Н2С2О4·2Н2О) – ? |
|
|
Відповідь: ω(Н2С2О4·2Н2О) = 74,04 % |
Лабораторна робота приготування та стандартизація титранту натрій гідроксиду
Мета: навчитися готувати стандартні розчини (первинні та вторинні) методу кислотно-основного титрування, встановити концентрацію натрій гідроксиду за допомогою первинного стандарту оксалатної кислоти.
Суть методу: аліквотну частину розчину первинного стандарту оксалатної кислоти відтитровують розчином титранту натрій гідроксиду в присутності кислотно-основного індикатору.
Аналітичні прийоми: пряме титрування, метод піпетування.

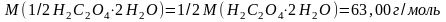
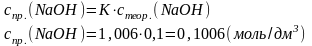
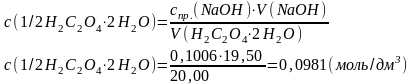
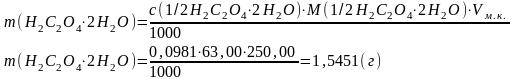
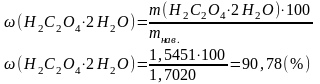
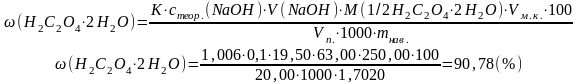
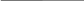 с(NaOH)=
0,1055 моль/дм3
с(NaOH)=
0,1055 моль/дм3