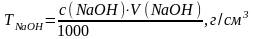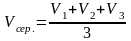- •Глава 1. Основні положення титриметричного аналізу
- •Вимоги до реакцій у титриметричному аналізі
- •Класифікація методів титриметрії в залежності від типу реакції
- •Класифікація методів титриметрії за способом титрування
- •Способи приготування стандартних розчинів
- •1. Приготування первинних стандартних розчинів
- •2. Приготування вторинних стандартних розчинів
- •3. Приготування стандартних розчинів із фіксаналів
- •Глава 2. Розрахунки в титриметричному аналізі
- •2.1. Способи виразу концентрації речовин у розчинах у титриметрії
- •Глава 3. Метод кислотно–основного титрування Теоретичні основи
- •Індикатори методу кислотно-основного титрування
- •Показник індикаторів рК, показник титрування рН
- •Класифікація індикаторів
- •Криві титрування
- •1. Титрування сильних кислот сильними основами (Рис 1.)
- •2.Титрування слабких основ сильними кислотами. (Рис 2.)
- •3. Титрування слабких кислот сильними основами.(Рис 3.)
- •4. Титрування слабких кислот слабкими основами. (Рис. 4)
- •5. Титрування багатоосновних кислот (Рис 5.)
- •Кислотно-основне титрування в неводних середовищах
- •Робочі розчини у методах неводного титрування
- •Практичне використання методів кислотно-основного титрування в аналізі фармацевтичних препаратів
- •Практична робота способи виразу вмісту речовин у розчинах
- •Приклади розв’язання задач
- •Практична робота розрахунок результатів аналізу в титриметрії
- •Приклади розв'язання задач
- •Використаний аналітичний прийом – метод піпетування.
- •Розв’язання задачі
- •Використаний прийом – метод окремих наважок.
- •Розв’язання задачі
- •Лабораторна робота приготування та стандартизація титранту натрій гідроксиду
- •Хімізм процесу
- •План експерименту
- •Висновок
Хімізм процесу
H2C2O4 + 2NaOH → Na2C2O4 + 2H2O
М(NaOH) = 40,00 г/моль; М(1/2H2C2O4·2H2O) = 63,04 г/моль
Вибір індикатору: продуктами реакції є сіль і вода. Натрій оксалат – сіль утворена слабкою кислотою та сильною основою, тому підлягає гідролізу, в результаті якого рН середовища більше 7:
С2О42-
+ H2O
HC2O4-
+ OH-
рН
 9,3
9,3
Індикатор: фенолфталеїн.
План експерименту
І. Приготування титранту натрій гідроксиду
1. Розрахунок маси наважки натрій гідроксиду для приготування розчину з молярною концентрацією еквіваленту 0,05 моль/дм3:
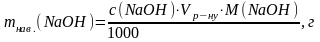
Якщо об’єм розчину 500 см3, то:
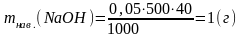
2. Взяття наважки на техно-хімічних терезах в скляному бюксі або порцеляновій чашці.
3. Приготування та зберігання розчину лугу.
Наважку лугу пересипати в хімічний термостійкий стакан, розчинити у кип’яченій дистильованій воді, перелити в посуд для зберігання розчину. При приготуванні лугів треба враховувати, що їх розведені розчини дуже швидко поглинають з повітря вуглекислий газ і концентрація їх змінюється. Концентровані розчини лугу реагують з вуглекислим газом повільно, тому готують концентровані розчини і лише перед використанням їх розбавляють очищеною кип’яченою водою. Зберігати розчини лугу слід герметично зачиненими, але використовувати скляні притерті пробки в даному випадку неможливо. Розчини лугу зберігають у бутилях, щільно закритими гумовими пробками з двома отворами: в один отвір вставляють хлоркальцієву трубку (СаCl2 + NaOH), а другий отвір склянки служить для трубки-сифону, через який відбирають розчин лугу.
ІІ. Приготування розчину первинного стандарту оксалатної кислоти
Розрахунок маси наважки оксалатної кислоти:

Якщо с(1/2Н2С2О4·2Н2О) = 0,05 моль/дм3, Vм.к. = 250,00 см3:
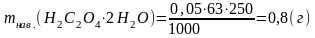
Взяття наважки оксалатної кислоти на аналітичних терезах в межах mнав ± 0,1 г:
Результати зважування занести в лабораторний журнал.
-
mб з нав.
=
mб.
=
mнав.
=
Приготування розчину оксалатної кислоти в мірній колбі об’ємом 250,00 см3.
У мірну колбу за допомогою лійки перенести наважку оксалатної кислоти, ополоснути бюкс і лійку декілька разів дистильованою водою, розчинити наважку кислоти приблизно в 100 см3 води, довести до мітки об’єм розчину водою і ретельно перемішати.
ІІІ. Стандартизація розчину натрій гідроксиду
Процес титрування:
У колбу для титрування за допомогою піпетки відібрати аліквотну частину розчину первинного стандарту оксалатної кислоти, додати 2-3 краплі індикатору фенолфталеїну і титрувати розчином натрій гідроксиду до рожевого забарвлення, яке утримується приблизно 30 сек.
Титрування повторити не менш 3 разів до одержання відтворюваних результатів.
Результати титрування записати в таблицю:
|
1 |
2 |
3 |
|
V(H2C2O4), см3 |
|
|
|
|
V(NaOH), см3 |
|
|
|
|
Розрахунок результатів аналізу:
3.1. Розрахунок молярної концентрації еквіваленту розчину оксалатної кислоти:
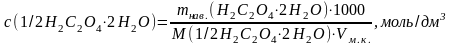
Розрахунок молярної концентрації еквіваленту розчину натрій гідроксиду за законом еквівалентів:
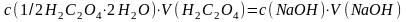
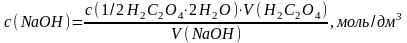
3.3. Розрахунок коефіцієнту поправки розчину натрій гідроксиду, якщо стеор. = 0,05 моль/дм3:
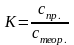
3.4. Розрахунок титру натрій гідроксиду: