
- •Безопасность жизнедеятельности
- •1. Контроль состава воздуха.
- •2. Метеорологические условия на производстве и их влияние на организм человека.
- •3.Защитное заземление.
- •З ануление.
- •4. Условия поражения человека током в сетях напряжением до 1 кВ.
- •5. Защита атмосферного воздуха от загрязнения промышленными выбросами.
- •6. Оказание первой помощи пострадавшему.
- •7. Правила котлонадзора.
- •8. Приборы безопасности.
- •9. Предохранительные устройства топки и газоходов.
- •Предохранительные клапаны.
- •Энергосбережение в теплоэнергетике и теплотехнологиях Теоретические основы теплотехники
- •1. Первый закон термодинамики и его математическое обоснование.
- •2. Второй закон термодинамики и его математические выражения. Круговые процессы. Цикл Карно (прямой и обратный) и его анализ. Понятие о обобщённом цикле Карно.
- •4. Эксергия, её свойства и физический смысл. Эксергия теплоты, потока и квазистатической системы.
- •5. Уравнения состояния идеальных и реальных газов и паров.
- •7. Циклы пту. Общая характеристика. Цикл Ренкина и его анализ. Методы повышения эффективности циклов пту.
- •8. Циклы теплофикационных пту.
- •Нетрадиционные и возобновляемые источники энергии
- •1. Виды возобновляемых источников энергии и возможности их использования.
- •Способы использования энергии солнца.
- •3. Использование энергии ветра.
- •4. Использование энергии воды.
- •5. Использование энергии биомассы.
- •Энергетические системы обеспечения жизнедеятельности
- •1. Теплотехнический расчет наружного ограждения.
- •2. Определение теплопотерь отапливаемого помещения.
- •3. Схемы систем водяного отопления
- •4. Преимущества и недостатки парового отопления по сравнению с водяным.
- •5. Системы воздушного отопления.
- •6. Системы кондиционирования воздуха.
- •7. Схемы внутреннего водопровода.
- •8. Элементарные процессы обработки воздуха в I – d диаграмме.
- •Источники и системы теплоснабжения промышленных предприятий
- •1. Устройство и работа тэс.
- •2. Выбор начальных параметров пара на кэс и в котельной.
- •3. Регенеративный подогрев питательной воды на тэс.
- •4. Термическая деаэрация питательной воды.
- •5. Способы выработки производственного пара на тэц.
- •6. Схема выработки горячей воды на тэц.
- •7. Экономия топлива при комбинированной выработке энергии на тэц.
- •8. Устройство и работа водогрейной котельной.
- •9. Устройство и работа паровой котельной.
- •10. Присоединение систем отопления к тепловой сети.
- •Зависимые схемы присоединения систем отопления.
- •Схемы с насосом и элеватором
- •11. Схемы присоединения систем горячего водоснабжения. Закрытые тепловые сети.
- •Двухступенчатая смешанная схема горячего водоснабжения.
- •Двухступенчатая последовательная схема.
- •Двухступенчатая смешанная схема с ограничением максимального расхода воды на ввод.
- •Открытые тепловые сети.
- •12. Пьезометрический график
- •Отопительно-бытовой график центрального качественного регулирования
- •Регулирование разнородной нагрузки при отопительном графике.
- •Центральное качественное регулирование по совмещенной нагрузке.
- •15. Тепловой расчет трубопроводов.
- •16. Устройство и конструктивные особенности тепловых сетей.
- •17. Испытания тепловых сетей.
- •1. Гидравлические испытания на прочность и плотность
- •2. Испытания на максимальную температуру теплоносителя.
- •3. Испытания на тепловые потери.
- •4. Испытания на гидравлические потери
- •5.Испытания на потенциалы блуждающих токов.
- •18. Защита теплосети от коррозии
- •Контроль за использованием блуждающих токов
- •Котельные установки и парогенераторы
- •1. Общая характеристика топлив и классификация топлив.
- •Классификация топлив.
- •2. Термические характеристики топлив.
- •3. Подготовка к сжиганию твердого топлива.
- •4. Закономерности измельчения топлива.
- •6. Тепловой баланс котельного агрегата.
- •Кпд котельного агрегата и расход топлива.
- •7. Принципиальная технологическая схема котельной установки и ее оборудование
- •Тепломассообменное оборудование промышленных предприятий
- •Основные виды расчетов тепломассообменных аппаратов
- •Классификация тепломассообменных аппаратов
- •Методика теплового расчета рекуперативных тепломассообменных аппаратов
- •Деаэраторы
- •Выпарные установки
- •Гидравлический расчет рекуперативных тепломассообменных аппаратов
- •Сушильные установки и рациональное использование тепловой энергии
- •Тепловые двигатели и нагнетатели
- •Принцип действия основных типов нагнетателей (центробежный, осевой, вихревой, поршневой, ротационный, струйный, эрлифт).
- •Производительность, напор, давление, мощность и кпд нагнетателя.
- •Характеристики центробежного нагнетателя (напор, мощность, кпд).
- •Способы регулирования центробежных нагнетателей.
- •Параллельное и последовательное соединение центробежных нагнетателей.
- •7.Принцип действия, работа, мощность и кпд поршневого компрессора.
- •10. Характеристики и методы регулирования производительности осевых нагнетателей.
- •11. Классификация и обозначение паровых турбин.
- •12. Мощности и кпд паротурбинных установок.
- •13. Преобразование энергии парового потока в турбинной ступени. Активная ступень.
- •Реактивная ступень.
- •14. Виды внутренних и внешних потерь в паровой турбине. Внутренние потери
- •Внешние потери.
- •15. Способы парораспределения в паровых турбинах.
- •16. Турбины с промежуточными регулируемыми отборами пара.
- •Турбина с одним отбором.
- •Т урбины с 2-мя промежуточными регулируемыми отборами пара.
- •Технологические энергоносители предприятий
- •1. Виды нагрузок на воздушную компрессорную станцию и выбор воздушного компрессора.
- •2. Вспомогательное оборудование воздушных компрессорных станций.
- •5. Классификация холодильных машин.
- •6. Работа одноступенчатой парокомпрессионной холодильной машины. Схема парокомпрессионной холодильной установки.
- •7. Схема простейшей абсорбционной холодильной машины.
- •8. Подготовка воздуха к промышленному разделению.
- •9. Схемы производственных систем водоснабжения.
- •Теплоэнергетические системы промышленных предприятий
- •1. Способы теплоснабжения жилых поселков. Их характеристика и эффективность.
- •2. Расчет тепловых нагрузок коммунальных потребителей и промышленных предприятий по удельным тепловым потокам. Расчет отопительной нагрузки.
- •Расчет вентиляционной нагрузки.
- •Расчет нагрузки гвс.
- •3. Выбор теплоносителя, его параметров и расхода.
- •4. Выбор паровых турбин и энергетических паровых котлов тэц.
- •5. Выбор оборудования теплофикационной установки тэц. Ремонт и эксплуатация теплоэнергетического оборудования
- •1. Эксплуатация топливного хозяйства.
- •2.Основы эксплуатации котельных установок. Пуск, останов, случаи аварийного останова.
- •Останов котла.
- •Аварийные случаи останова котла
- •3.Эксплуатация центробежных машин. Вентиляторы. Насосы. Дымососы.
- •5.Методы очистки поверхностей нагрева. Очистка поверхностей нагрева от золы.
- •6.Методы повышения надежности сложных систем
- •7. Ремонт энергооборудования.
- •9.Приемка оборудования из ремонта.
- •Охрана окружающей среды в энергетике
- •1. Нормирование выбросов в атмосферу
- •2. Сравнительные хар-ки сухих инерционных з/ул-ей
- •3. Аппараты мокрой очистки газов
- •5. Снижение выбросов оксидов серы и азота.
- •7. Упрощенные малозатр-е техн-гии сероочистки
- •8. Очистка дымовых газов от оксидов азота.
- •9. Режимно-конструктивные мероприятия по снижению nOx.
- •10. Выбор высоты дымовой трубы по условиям рассеивания
4. Эксергия, её свойства и физический смысл. Эксергия теплоты, потока и квазистатической системы.
Эксэргия и эксергетический метод анализа теплотехники являются дополнением к энергетическому методу анализа.
Рассмотрим процесс теплообмена между 2мя телами, имеющими постоянные температуры Т1 и Т2.
Эксергия – максимальная работа, которую может совершить система при переходе из данного состояния в состояние равновесия с окружающей средой.

![]()
Определим изменение энтропии системы.
![]()
![]()
![]()
 -
коэффициент Карно или эксергетическая
температура.
-
коэффициент Карно или эксергетическая
температура.

![]() - Уравнение Гюи –
Стодла
- Уравнение Гюи –
Стодла
Эксергия позволяет объяснить физический смысл энтропии.
Энтропия рассматривается в термодинамической системе как калорический параметр состояния, возрастание которого при протекании в ней необратимых процессов прямопропорционально уменьшению эксэргии этой системы.
Рассмотрим сравнительные свойства энергии и эксэргии.
Энергия |
Эксэргия |
1. Определяет параметры состояния термодинамической системы. |
1. Определяет параметры системы и окружающей среды. |
2. Изолированная система остаётся неизменной при протекании необратимых процессов |
2. Стремится к 0 при протекании необратимых процессов |
3. Окр. ср. → ∞ |
3. Окр. ср. близка к 0 |
4. Превращение в другие виды ограничено 2м законом термодинамики |
4.Неограничена |
![]()
Виды эксэргии и их определения.
1. Эксэргия тел с постоянной температурой.
2. Эксэргия тел с переменной температурой.
3. Эксэргия поточных систем.
4. Эксэргия квазистатических систем.
1. Эксэргия тел с переменной температурой.

![]()

Если рабочее тело в системе – газ, то



Эксэргия потока.


1-В – изотропный;
В-ОС – обратимый изотермический;
![]()
hB=hOC, т.к. ТB=ТОС.
![]()
![]()
![]()
![]()
ex=h1-ha
Эксэргия квазистатической системы.
К квазистатической системе относят закрытые условно неподвижные системы (сжатый газ, находящийся в баллоне; пропарочная камера) Определим эксэргию квазистатической системы.
1 -b-oc
– обратимый переход;
-b-oc
– обратимый переход;
1-b – обратимый адиабатный (изотропный) переход;
b-оc – обратимый изотермический переход.

В общем виде:
![]()
Помимо
определения эксэргии при анализе
определяют также эксэргетический КПД
процессов и устройств.
 - эксэргетический КПД процесса горения.
- эксэргетический КПД процесса горения.
Для
систем не производящих полезную работу
(теплообменные аппараты) эксэргетический
КПД определяют следующим образом:
![]()
Для
систем производящих полезную работу
(тепловые двигатели, турбины)
![]() ,
,
lтд – действительная работа турбины.
Эксэргетический анализ термодинамических процессов и систем является дополняющим к широко известному энергетическому методу. В отличии от энергетического метода эксэргетический позволяет учитывать не только количество, но и качество используемой энергии. С помощью этого метода можно выявлять те участки цепи технологического преобразования и использования энергии, где потери эксэргии наибольшие.
5. Уравнения состояния идеальных и реальных газов и паров.
Известно, что вещество может находиться в одном из 4х фазовых состояний: твёрдое, жидкое, газообразное и плазма, и это определяется значениями параметров состояния. Но в пределах одной фазы состояние и даже свойства вещества могут существенно отличаться, если различны параметры состояния.
Каждому состоянию соответствует определённые значения характеристических функций, например u=f(p, V, T). Ссылаясь на свойства этих функций, можно утверждать, что существует определённая однозначная связь между отдельными параметрами состояния.
Исследованиями свойств газов и разработкой уравнений состояния занимается физика. В общем случае это сложная и трудоёмкая задача. Для идеального газа (такие состояния газа, при которых можно пренебрегать силами взаимодействия между молекулами и объёмами самих молекул) уравнение состояния, которое называют обычно уравнением Клапейрона принимает вид:
p·V=R·T,
где R – газовая постоянная, своя для каждого газа, R=8314/μ, Дж/кг; μ – молекулярная масса газа, кг/моль.
Уравнение Клапейрона непригодно для описания реальных газов, особенно при высоких Р и низких T. Даже при нормальных условиях это уравнение для некоторых газов даёт погрешность 2÷3 %.
Уравнение Клапейрона не учитывает:
1. Размеров молекул;
2. Силы взаимодействия между молекулами;
3. Явление ассоциации молекул.
Наиболее
простым и достаточно хорошо теоретически
обоснованным считается уравнение
Ван–Дер.–Вальса.
![]()
У равнение
может иметь 3 вещественных корня или 1
вещественный и 2 мнимых. Практическое
значение имеют вещественные корни.
равнение
может иметь 3 вещественных корня или 1
вещественный и 2 мнимых. Практическое
значение имеют вещественные корни.
Критические параметры состояния связаны с коэффициентами a и b соотношениями:

Уравнение Ван–Дер.–Вальса достаточно хорошо описывает свойства реальных газов и паров, однако не удовлетворяет практическим целям с количественной точки зрения.
6. T-S и H-S – диаграммы водяного пара. Основные паровые процессы и их расчёт.
Наряду с T-S диаграммами широко применяют H-S диаграммы.
Основным преимуществом H-S диаграммы перед T-S является то, что в ней характерное действие представлено в виде отрезков, а не площадей.
К паровым процессам относят 4 элементарных термодинамических процесса: изобарный, адиабатный, изотермический и изохорный. Наибольшее практическое значение имеют 2 первых.
Расчёт тепловых процессов обычно выполняют графо – аналитическими методами с помощью H-S диаграмм и некоторых расчётных выражений (уравнение 1го закона термодинамики).
1. Изобарный процесс P=const.
Реализуется в пароводяных теплообменниках, котлах, конденсаторах.
Рассмотрим процесс изобарного подвода теплоты к водяному пару.



![]()
![]()
![]()
![]()
Адиабатный процесс
Реализуется для воды в насосах, в соплах турбин, эжекторах, а также в парокомпрессионных и пароэжекторных холодильных машинах и тепловых насосах.


![]() ;
;
q=0; ΔS=0;
l’=h1-h2;
l=U1-U2=h1+h2-(P1·V1-P2·V2).
Для приближённых расчётов при низких давлениях пара Р1≤ 2÷2,5 МПа может использоваться методика Выхухоля
![]()
![]()
![]()
![]()
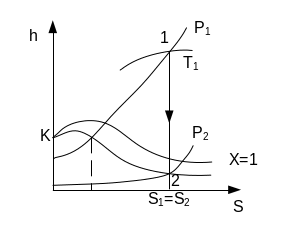

Если расширение происходит в области перегретого пара, то Кср≈1,3.
Для области влажного насыщенного пара Кср=1,035+0,1·х
Изотермический процесс.
Самостоятельного значения не имеет, реализован лишь в 2х фазной области при протекании процессов парообразования или конденсации.



![]()
![]()
![]()
![]()
В отличии от идеального газа внутренняя энергия водяного пара не остаётся постоянной, наиболее значительно внутренняя энергия изменяется в 2х фазной области, т.е. в процессе 1-2. Это связано со значительными затратами энергии на преодоление сил межмолекулярногосцепления (диагрегация молекул). В процессе а-2 изменение внутренней энергии уже незначительно.
Изохорный процесс.



Изохорный процесс водяного пара реализуется в различных автоклавных печах.
![]()
![]()
![]()
