- •1. Техническая термодинамика. Основные понятия: термодинамическая система, рабочее тело, основные параметры состояния.
- •2. Реальный газ. Уравнение Ван-дер-Ваальса и Вукаловича-Новикова.
- •3. Теплоёмкость газов. Зависимость теплоёмкости от температуры. Теплоёмкость смеси газов.
- •4. Внутренняя энергия. Энтальпия.
- •5. 1 Закон тд. Работа расширения или сжатия газа.
- •6. Изобарный, адиабатный.
- •7. Изохорный и изотермический.
- •8. 2 Закон тд.
- •9. Круговые процессы. Прямые и обратные циклы. Оценка их эффективности. Цикл Карно.
- •10. Водяной пар. Фазовая Pt – диаграмма водяного пара.
- •12. Одноступенчатый паровой компрессор. Определение работы сжатия в различных процессах.
- •13. Многоступенчатое сжатие. Его преимущество перед одноступенчатым сжатием.
- •14. Пояснить целесообразность охлаждения поршневого компрессора. Имеет ли одноступенчатый поршневой компрессор предел сжатия?
- •15. Циклы двс. Сравнение циклов.
- •16. Схема и циклы гту. Сравнительный анализ двс и гту.
- •16.2. Рабочий процесс гту
- •17. Псу, цикл Ренкина, его кпд. Способы повышения кпд цикла Ренкина.
- •18. Схемы и циклы парогазовой установки.
- •21. Схема и цикл компрессионной установки.
- •22. Тепловой насос. Определение его эффективности.
- •24. Основы теплофикации. Оценка эффективности тэц.
- •25. Теплопередача. Способы передачи теплоты. Основные закономерности. Физика процессов.
- •26. Температурное поле. Градиент температуры. Закон Фурье.
- •27. Теплопроводность через однослойную и многослойную стенки. Теплопроводность цилиндрической стенки.
- •28. Конвекционный теплообмен. Закон Ньютона – Рихмана. Факторы влияющие на интенсивность кто.
- •29. Критериальные уравнения кто. Свободная и вынужденная конвекция.
- •30. Теплообмен излучением. Законы излучения твёрдых тел. Применение экранов.
- •31. Излучение газов. Отличие от излучения твёрдых тел, их закономерности.
- •32. Виды теплообменных аппаратов. Основные расчетные уравнения.
- •33. Конструктивный поверочный расчёт теплообменников.
- •34. Теплопередача. Коэффициент передачи через плоскую стенку. Его физический смысл.
- •35. Топливо. Способы задания топлива, состав топлива.
- •36. Основные технические характеристики твёрдого топлива.
- •37. Котельные установки. Основное вспомогательное оборудование.
- •38. Тепловой баланс парогенератора.
- •39. Водоподготовка.
- •40. Теплообменники. Прямо- и противоточные схемы движения теплоносителей, их особенности.
- •41. Теплота сгорания топлива. Условное топливо.
1. Техническая термодинамика. Основные понятия: термодинамическая система, рабочее тело, основные параметры состояния.
Техническая термодинамика (ТТ) – раздел науки в котором рассматривается взаимодействие превращения тепловой и механической энергии.
ТТ базируется на 1 и 2 законах термодинамики и является основой теории тепловых двигателей и других промышленных установок. Основным понятием ТТ является периодичность системы ТДС под которой подразумевается совокупность тел или частиц одного типа находящихся во взаимодействии как между собой так и с окружающей средой.
Основные термодинамические параметры состояния.
1. р
– давление
![]()
Параметром состояния ТДС является абсолютное давление.
![]() Рм
– избыточное
монометрическое давление, Рб
– атмосферное, барометрическое давление.
Рм
– избыточное
монометрическое давление, Рб
– атмосферное, барометрическое давление.
Р = Рб – Рв
Рв – давление вакуума.
2. Температура.
Параметром состояния системы является только абсолютная температура.
Т = t + 273.16
Термодинамический процесс.
Основные параметры состояния p, U,T связанные между собой математической зависимостью: F(p,U,T)=0, которая в термодинамике называется уравнением состояния.
Процесс изменения состояния может быть равновесным или не равновесным, может быть обратимым и не обратимым.
2. Реальный газ. Уравнение Ван-дер-Ваальса и Вукаловича-Новикова.
Реальный газ, газ, свойства которого существенно зависят от взаимодействия молекул. В обычных условиях, когда средняя потенциальная энергия взаимодействия молекул много меньше их средней кинетической энергии, свойства Р. г. незначительно отличаются от свойств идеального газа и к Р. г. применимы законы, установленные для идеального газа. Отличие свойств Р. г. от идеального становится особенно значительным при высоких давлениях и низких температурах, когда начинают проявляться квантовые эффекты.
Отличается от идеального газа существованием взаимодействия между его частицами (молекулами, атомами). При малых плотностях наличие межмолекулярного взаимодействия учитывается вириальным уравнением состояния реального газа:
pV = RT[1 + B(T)/v + C(T)/v2 + ...],
где p - давление, v - мольный объем, Т - абсолютная температура, R - газовая постоянная, В(Т), С(Т) и т. д. - вириальные коэффициенты, зависящие от температуры и характеризующие парные, тройные и т. д. взаимодействия частиц в газе. Существуют и др. полуэмпирические и теоретические уравнения состояния реального газа, напр. уравнение Ван-дер-Ваальса.
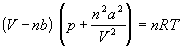
3. Теплоёмкость газов. Зависимость теплоёмкости от температуры. Теплоёмкость смеси газов.
В термодинамических процессах в общем случае к рабочему телу либо подводится либо отводится. Для анализа процесса необходимо знать количество подводимой или отводимой теплоты. Для этого пользуются понятием теплоёмкости газов.
Удельной теплоёмкостью Сх рабочего тела в данном процессе называется количество теплоты dg, которое надо сообщить единице количества газа в данном процессе, чтобы повысить его температуру на 1 градус С.
![]()
т.к количество вещества может задаваться либо массой, либо объёмом, либо числом кМолей, в термодинамике различают теплоемкости: массовую, объёмную и мольную.
![]() - массовая,
- массовая,
![]() - объёмная,
- объёмная,
![]() - мольная.
- мольная.
![]()
СП и СВ теплоёмкости.
Ср и Сv .
Cр = Сv + R – уравнение Майера.
![]() - коэффициент
Пуассона.
- коэффициент
Пуассона.
![]() - показатель
адиабаты.
- показатель
адиабаты.
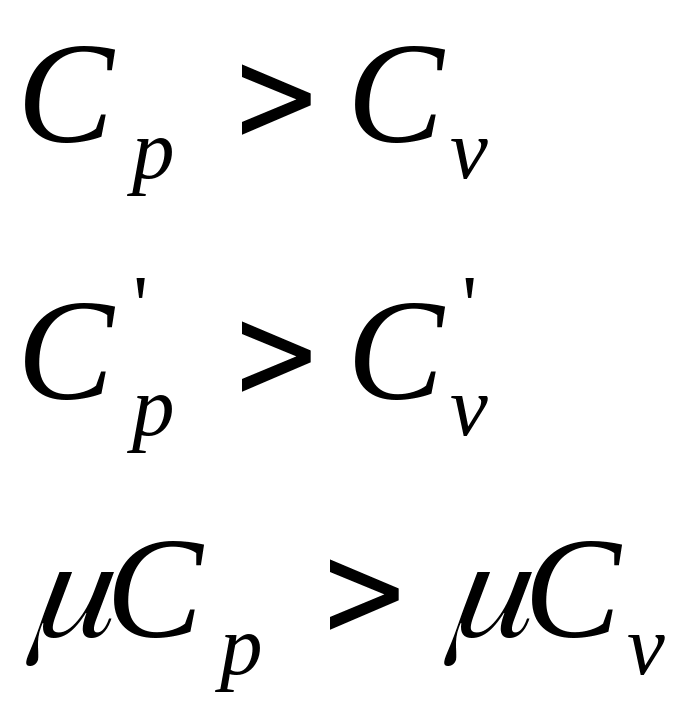 всегда!
всегда!