
- •1. Техническая термодинамика. Основные понятия: термодинамическая система, рабочее тело, основные параметры состояния.
- •2. Реальный газ. Уравнение Ван-дер-Ваальса и Вукаловича-Новикова.
- •3. Теплоёмкость газов. Зависимость теплоёмкости от температуры. Теплоёмкость смеси газов.
- •4. Внутренняя энергия. Энтальпия.
- •5. 1 Закон тд. Работа расширения или сжатия газа.
- •6. Изобарный, адиабатный.
- •7. Изохорный и изотермический.
- •8. 2 Закон тд.
- •9. Круговые процессы. Прямые и обратные циклы. Оценка их эффективности. Цикл Карно.
- •10. Водяной пар. Фазовая Pt – диаграмма водяного пара.
- •12. Одноступенчатый паровой компрессор. Определение работы сжатия в различных процессах.
- •13. Многоступенчатое сжатие. Его преимущество перед одноступенчатым сжатием.
- •14. Пояснить целесообразность охлаждения поршневого компрессора. Имеет ли одноступенчатый поршневой компрессор предел сжатия?
- •15. Циклы двс. Сравнение циклов.
- •16. Схема и циклы гту. Сравнительный анализ двс и гту.
- •16.2. Рабочий процесс гту
- •17. Псу, цикл Ренкина, его кпд. Способы повышения кпд цикла Ренкина.
- •18. Схемы и циклы парогазовой установки.
- •21. Схема и цикл компрессионной установки.
- •22. Тепловой насос. Определение его эффективности.
- •24. Основы теплофикации. Оценка эффективности тэц.
- •25. Теплопередача. Способы передачи теплоты. Основные закономерности. Физика процессов.
- •26. Температурное поле. Градиент температуры. Закон Фурье.
- •27. Теплопроводность через однослойную и многослойную стенки. Теплопроводность цилиндрической стенки.
- •28. Конвекционный теплообмен. Закон Ньютона – Рихмана. Факторы влияющие на интенсивность кто.
- •29. Критериальные уравнения кто. Свободная и вынужденная конвекция.
- •30. Теплообмен излучением. Законы излучения твёрдых тел. Применение экранов.
- •31. Излучение газов. Отличие от излучения твёрдых тел, их закономерности.
- •32. Виды теплообменных аппаратов. Основные расчетные уравнения.
- •33. Конструктивный поверочный расчёт теплообменников.
- •34. Теплопередача. Коэффициент передачи через плоскую стенку. Его физический смысл.
- •35. Топливо. Способы задания топлива, состав топлива.
- •36. Основные технические характеристики твёрдого топлива.
- •37. Котельные установки. Основное вспомогательное оборудование.
- •38. Тепловой баланс парогенератора.
- •39. Водоподготовка.
- •40. Теплообменники. Прямо- и противоточные схемы движения теплоносителей, их особенности.
- •41. Теплота сгорания топлива. Условное топливо.
4. Внутренняя энергия. Энтальпия.

одноатомный газ имеет 3 степени свободы поступательного движения.
 3
степени свободы + 2 степени свободы
вращательного движения.
3
степени свободы + 2 степени свободы
вращательного движения.
СО2 – 3 вращательных + 3 поступательных = 6 степеней свободы.
Каждая молекула обладает кинетической энергией поступательного и вращательного движения и при высоких температурах молекула обладает энергией внутримолекулярных колебаний (для ид.газа). При рассмотрении реального газа каждая молекула обладает потенциальной энергией, зависящей от сил притяжения и отталкивания.
Для идеального
газа
![]()
Для реального газа
![]()
![]()
![]()
Энтальпия – сумма внутренних энергий термодинамической системы и произведение абсолютного давления на объём.
h = U + pV
![]() ,
при р = const
=> что
,
при р = const
=> что
![]() или
или
![]() =>
=>
Удельная энтальпия – это теплота сообщаемая единице вещества в изобарном процессе.
Энтальпия через
теплоёмкость
![]() при p
= const
при p
= const
![]()
5. 1 Закон тд. Работа расширения или сжатия газа.
- закон сохранения и превращения энергии.
Энергия не исчезает и не берётся ни откуда, она переходит лишь из одного вида в другой. Полная энергия изолированной системы постоянна.
Первый закон термодинамики не отвечает на вопрос в каком направлении при тепло обмене между двумя телами передаётся теплота.
1 закон термодинамики отрицает существование вечного двигателя второго рода.
Теплота g подведённая к телу, в общем случае расходуется на изменение внутренней энергии тела и на совершение работы.
![]()
если работа совершается только в виде работы расширения, то
![]()
1 закон имеет общую характеристику для любых систем неподвижных, движущихся, потока жидкости или газа.
![]()
h – энтальпия, (h = U+P+V), W – скорость потока, Y – высота, lтехн – техническая работа потока.
Работа расширения или сжатия газа
![]()

6. Изобарный, адиабатный.
Изобарный процесс.
![]() - уравнение состояния
идеального газа.
- уравнение состояния
идеального газа.
При Р=const
получаем
![]() или
или
![]() ,объём
газа пропорционален его температуре.
,объём
газа пропорционален его температуре.
![]()


![]()
Изменение S:
![]()
Адиабатный процесс.
Это процесс
происходящей без теплообмена с окружающей
средой,
![]()
![]() где
где
![]() -
показатель адиабаты.
-
показатель адиабаты.

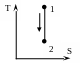

Поскольку при адиабатном процессе , энтропия рабочего тела не изменяется
![]() и
и
![]() на
на
![]() диаграмме получаем вертикальную прямую.
Теплоёмкость данного процесса равен
0.
диаграмме получаем вертикальную прямую.
Теплоёмкость данного процесса равен
0.
7. Изохорный и изотермический.
Изохорный процесс.
![]() или
или
![]()
- уравнение состояния идеального газа.
При
получаем
![]() давление
прямо пропорционально его температуре.
давление
прямо пропорционально его температуре.
и ли
ли![]()
![]() т.к.
т.к.
![]() при
при
![]()
![]() при
при
![]()
т.к.
то
![]()
![]()
Изотермический процесс.
![]()
![]()
![]() или
или
![]() Р и
Р и![]() обратно пропорциональны.
обратно пропорциональны.
![]()
т .к.
.к.
![]()
![]()
![]()
и зменение
энтропии:
зменение
энтропии:
![]()
