
- •Список вопросов к экзамену
- •Молекулярно-кинетическая теория и термодинамика. Масса, атомная и молекулярная масса. Моль. Молярная масса. Число Авогадро.
- •Состояние системы, термодинамические параметры состояний. Равновесное состояние. Время релаксации.
- •Идеальный газ. Нормальные условия. Уравнение Клайперона. Универсальная газовая постоянная.
- •Закон Гей-Люссака (изобарический процесс). Закон Шарля (изохорический процесс). Закон Бойля-Мариотта (изотермический процесс).
- •Внутренняя энергия системы. Первое начало термодинамики.
- •Работа, совершаемая телом при изменениях его объема.
- •Температура. Температура по шкале Цельсия, Кельвина.
- •Изотермический, изобарический и изохорический процессы. Уравнение Клайперона.
- •Теплоемкость идеального газа. Молярная и удельная теплоемкость. Постоянная адиабаты.
- •Адиабатический процесс. Уравнение адиабаты. Политропические процессы.
- •Политропические процессы. Работа газа, совершаемая при различных процессах.
- •Молекулярно-кинетическая теория. Давление газа на стенку. Уравнение кинетической теории газов.
- •Кинетическая энергия поступательного движения молекулы. Постоянная Больцмана.
- •Степени свободы. Средняя энергия молекулы.
- •Распределение молекул по скоростям. Функция распределения.
- •Распределение молекул по модулю скорости.
- •Наиболее вероятная скорость, средняя скорость, среднеквадратичная скорость.
- •Барометрическая формула. Распределение Больцмана.
- •Основы термодинамики. Обратимый процесс. Круговой процесс (цикл). Кпд тепловой машины.
Распределение молекул по скоростям. Функция распределения.
Распределение Максвелла – в равновесном состоянии параметры газа (давление, объем и температура) остаются неизменными, однако микросостояния – взаимное расположение молекул, их скорости – непрерывно изменяются. Из-за огромного количества молекул практически нельзя определить значения их скоростей в какой-либо момент, но возможно, считая скорость молекул непрерывной случайной величиной, указать распределение молекул по скоростям. Распределение молекул по скоростям подтверждено различными опытами. Распределение Максвелла можно рассматривать как распределение молекул не только по скоростям, но и по кинетическим энергиям (так как эти понятия взаимосвязаны).
Выделим отдельную молекулу. Хаотичность движения позволяет например для проекции скорости Vx молекулы принять нормальный закон распределения. В этом случае, как показал Дж. К. Максвелл, плотность вероятности того, что молекула имеет компоненту скорости Ux, записывается следующим образом:
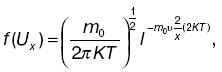
Можно получить максвелловскую функцию распределения вероятностей абсолютных значений скорости (распределение Максвелла по скоростям):
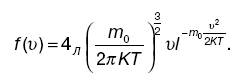
Распределение молекул по модулю скорости.
Обычно, более интересно распределение по абсолютному значению, а не по проекциям скоростей молекул. Модуль скорости, v определяется как:
![]()
поэтому модуль скорости всегда будет
больше или равен нулю. Так как все
![]() распределены
нормально, то
распределены
нормально, то
![]() будет
иметь хи-квадрат
распределение с тремя
степенями свободы. Если
будет
иметь хи-квадрат
распределение с тремя
степенями свободы. Если
![]() —
функция
плотности вероятности
для модуля скорости, то:
—
функция
плотности вероятности
для модуля скорости, то:
![]() ,
,
где
![]()
таким образом, функция плотности вероятности для модуля скорости равна
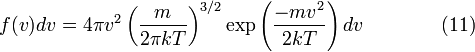
 – распределение Максвелла для модуля
скорости, которое определяет долю
хаотически движущихся молекул идеального
газа, которые имеют модуль скорости в
пределах от υ до υ+dυ.
– распределение Максвелла для модуля
скорости, которое определяет долю
хаотически движущихся молекул идеального
газа, которые имеют модуль скорости в
пределах от υ до υ+dυ.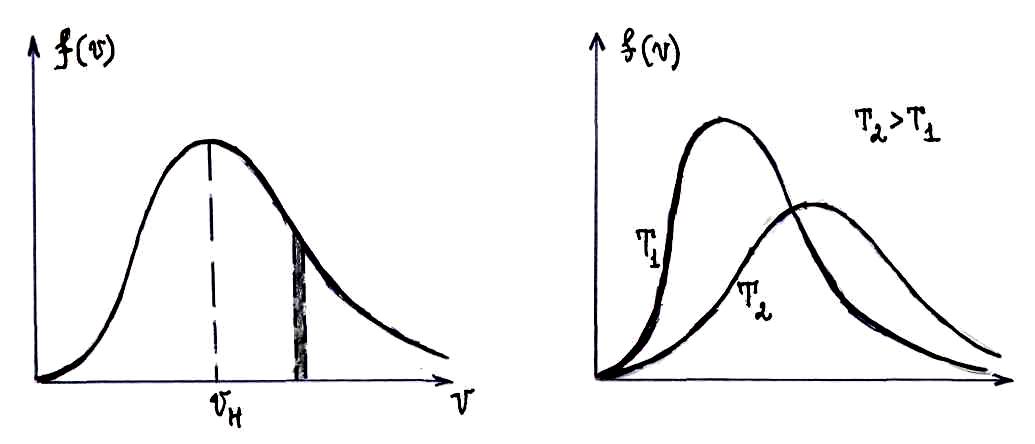
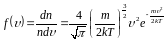 – функция распределения Максвелла для
модуля скорости.
– функция распределения Максвелла для
модуля скорости.
Наиболее вероятная скорость, средняя скорость, среднеквадратичная скорость.
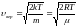 – наиболее вероятная скорость. Вероятность
обладания которой любой молекулой
системы максимальна, и которая
соответствует максимальному значению
– наиболее вероятная скорость. Вероятность
обладания которой любой молекулой
системы максимальна, и которая
соответствует максимальному значению
![]() .
Чтобы найти её, необходимо вычислить
.
Чтобы найти её, необходимо вычислить
![]() ,
приравнять её нулю и решить относительно
,
приравнять её нулю и решить относительно
![]() :
:
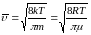 – средняя арифметическая скорость.
– средняя арифметическая скорость.
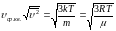 – средняя квадратичная скорость.
– средняя квадратичная скорость.
Барометрическая формула. Распределение Больцмана.
 – функция распределения Максвелла для
относительной скорости
– функция распределения Максвелла для
относительной скорости
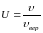 .
.
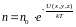 – распределение Больцмана, которое
определяет зависимость концентрации
молекул идеального газа от значения
потенциальной энергии; в частности в
однородном поле силы тяжести U=mgh
и
– распределение Больцмана, которое
определяет зависимость концентрации
молекул идеального газа от значения
потенциальной энергии; в частности в
однородном поле силы тяжести U=mgh
и
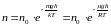 .
.
 – барометрическая формула.
– барометрическая формула.
Основы термодинамики. Обратимый процесс. Круговой процесс (цикл). Кпд тепловой машины.
Для любой термодинамической системы можно представить два состояния, между которыми будет проходить два процесса: один от первого состояния ко второму и другой, наоборот, от второго состояния к первому. Первый процесс называют прямым, второй — обратным. Если после прямого процесса 1—2 следует обратный 2—1 и при этом термодинамическая система возвращается в исходное состояние, то такие процессы принято считать обратимыми. При обратимых процессах система в обратном процессе проходит через те же равновесные состояния, что и в прямом процессе. При этом ни в окружающей среде, ни в самой системе не возникает никаких остаточных явлений.
Различают механически и термически обратимые процессы.
В механически обратимом процессе обмен энергией между системой и окружающей средой протекает в форме работы при бесконечно малой разности давлений.
В термически обратимом процессе термодинамическая система обменивается с окружающей средой энергией в форме теплоты при бесконечно малой разности температур.
Любой равновесный термодинамический процесс изменения состояния рабочего тела будет всегда обратимым. Обратимые процессы являются идеальными.
Действительные термодинамические процессы совершаются при конечной разности давлений и температур рабочего тела и окружающей среды и поэтому являются неравновесными. Такие процессы необратимы.
Необратимый термодинамический процесс – это процесс, при котором система не возвращается в исходное состояние после обратного процесса. Все необратимые процессы протекают в направлении достижения в термодинамической системе равновесия, то есть выравнивания в ней давлений, температур, концентраций.
Круговым процессом (или циклом) называется такой процесс при котором система после ряда изменении возвращается в исходное состояние. На графике цикл изображается замкнутой кривой Работа совершаемая при круговом процессе, численно равна площади охватываемой кривой. После совершения цикла система возвращается в прежнее состояние. Поэтому всякая функция состояния, в частности внутренняя энергия, имеет в начале и в конце цикла одинаковое значение.
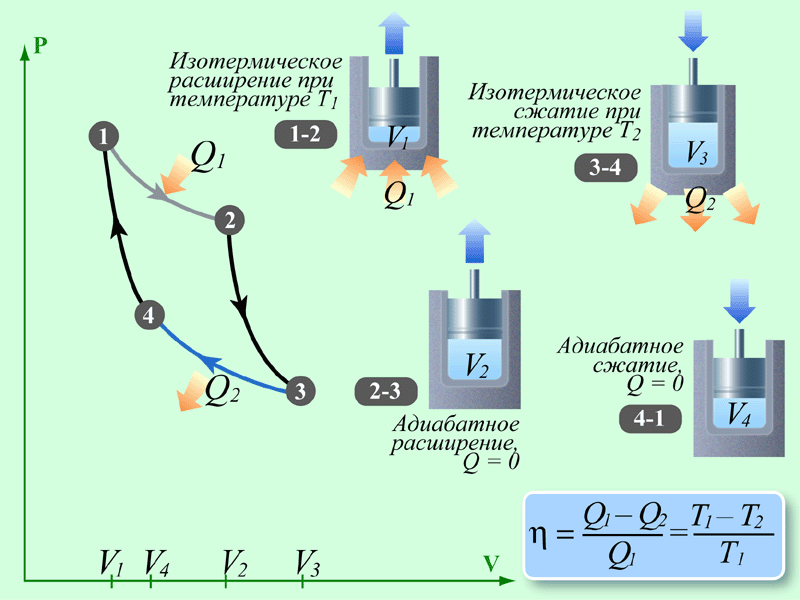
Второе начало термодинамики. Цикл Карно. КПД цикла Карно для идеального газа.
Элементы неравновесной термодинамики. Явления переноса. Эмпирические уравнения переноса (диффузия).
Элементы неравновесной термодинамики. Явления переноса. Эмпирические уравнения переноса (теплопроводность).
Элементы неравновесной термодинамики. Явления переноса. Эмпирические уравнения переноса (внутреннее трение).
Эффективный диаметр молекулы. Средняя длина свободного пробега. Общее уравнение переноса. Диффузия.
Эффективный диаметр молекулы. Средняя длина свободного пробега. Общее уравнение переноса. Вязкость.
Эффективный диаметр молекулы. Средняя длина свободного пробега. Общее уравнение переноса. Теплопроводность.
Энтропия. Изменение энтропии в изопроцессах. Изменение энтропии при обратимых и необратимых процессах. Свойства Энтропии.
Свободная энергия. Связанная энергия.
Статистический смысл энтропии.
Теорема Нернста. Энтропия идеального газа.
Опыт Боте. Фотоны. Характеристики фотонов.
Тормозное рентгеновское излучение.
Фотоны. Характеристики фотонов. Тормозное рентгеновское излучение.
Световые кванты. Фотоэффект. Красная граница фотоэффекта. Работа выхода. Формула Эйнштейна.
Опыт Комптона. Теория эффекта Комптона. Комптоновская длина волны.
Модель атома Томсона. Опыты по рассеянию альфа частиц. Ядерная модель атома.
Опыты по рассеянию альфа частиц. Формула Резерфорда. Ядерная модель атома.
Закономерности в атомных спектрах. Обобщённая формула Бальмера. Постоянная Ридберга. Серия Пашена, Бальмера, Лаймена.
Закономерности в атомных спектрах. Обобщённая формула Бальмера. Постулаты Бора.
Боровская модель атома водорода. Главное квантовое число. Боровский радиус.
Боровская модель атома водорода. Главное квантовое число. Энергия водородоподобного атома.
Обобщённая формула Бальмера. Постулаты Бора. Энергия связи. Энергия ионизации.
Гипотеза де-Бройля. Корпускулярные и волновые характеристики микрообъектов. Опыт по дифракции электронных пучков на кристаллах (опыт Дж. Томсона).
Гипотеза де-Бройля. Корпускулярные и волновые характеристики микрообъектов. Опыты с одиночными электронами (опыт В. Фабриканте).
Соотношения неопределенностей. Дифракция электронов на двух щелях.
Принцип неопределённости (Гейзенберга).
Волновая функция микрочастиц. Условие нормировки.
Уравнения Шредингера. Уравнение Шредингера для одномерного случая.
Уравнения Шредингера. Волновая функция свободно движущейся частицы. Смысл пси-функции.
Уравнения Шредингера. Движение частицы в бесконечно глубокой потенциальной яме.
Атом водорода. Энергетические уровни в атоме водорода.
Состав и характеристики атомного ядра. Основные характеристики атомного ядра. Зарядовое число. Массовое число. Изотопы.
Ядерные силы. Основные особенности ядерного взаимодействия.
Энергия связи атомных ядер. Радиоактивность. Постоянная распада. Основной закон радиоактивного распада. Период полураспада. Среднее время жизни.
Радиоактивность. Постоянная распада. Основной закон радиоактивного распада. Период полураспада. Альфа-распад.
Радиоактивность. Постоянная распада. Основной закон радиоактивного распада. Период полураспада. Бета-распад.
Радиоактивность. Постоянная распада. Основной закон радиоактивного распада. Период полураспада. Гамма-излучение.
Радиоактивность. Основные типы радиоактивности.
Элементарные частицы. Систематика элементарных частиц. Бозоны и фермионы. Лептоны. Адроны. Мезоны. Барионы.
Кварковая модель адронов. Шесть типов кварков. Глюоны.
