
- •7. *Общая характеристика и химические свойства германия, олова и свинца.
- •8.* Общая характеристика и химические свойства азота.
- •Получение
- •Химические свойства
- •Химические свойства
- •9. *Общая характеристика и химические свойства фосфора его получение в промышленности.
- •10. *Общая характеристика и химические свойства мышьяка, сурьмы и висмута.
- •11. Получение кислорода и пероксида водорода в промышленности и в лаборатории.
- •12. *Общая характеристика и химические свойства серы, селена и теллура.
- •13. Получение водорода в промышленности.
- •14.* Общая характеристика и химические свойства галогенов.
- •14. Фториды ксенона
- •15. Общая характеристика и свойства меди, золота, серебра
- •16. Общая характеристика и химические свойства элементов подгруппы цинка.
- •17. Общая характеристика и химические свойства подгруппы скандия.
- •18. Общая характеристика и химические свойства металлов подгруппы титана.
- •19. Общая характеристика и химические свойства элементов подгруппы ванадия.
- •20.* Общая характеристика и химические свойства хрома, молибдена и вольфрама.
- •21.* Общая характеристика и химические свойства марганца, технеция и рения.
- •22. Общая характеристика и химические свойства железа, кобальта и никеля.
- •23. Общая характеристика и химические свойства платиновых металлов.
- •24. Получение железа, никеля, хрома в промышленности.
- •25. Пирометаллургические способы получения металлов (свинец, медь, цинк) из сульфидных руд
- •26.Окислительное действие нитрата калия и хлората калия при нагревании (сплавлении).
- •27. Образование аммиакатов и гидроксокомплексов металлов и их разрушение кислотами и при нагревании.
- •28. Реакции термического разложения некоторых кислых солей ( NaHco3, NaH2po4, Na2hpo4, NaHso4).
8.* Общая характеристика и химические свойства азота.
**Оксиды азота: получение, строение молекул, окислительно-восстановительные свойства.
***Аммиак и гидразин: получение, химическая связь и строение молекул, кислотно–основные и окислительно-восстановительные свойства.
****Реакции термического разложения солей аммония: нитриты, нитрата, бихромата, сульфата, хлорида.
*****Гидроксиламин, азотистоводородная кислота и ее соли: химическая связь и строение молекул, получение и свойства.
******Взаимодействие металлов с азотной кислотой.
*******Царская водка и её окислительные свойства на примере реакций с золотом, платиной, сульфидом ртути.
********Реакции термического разложения нитратов различных металлов.
*Азот составляет большую часть атмосферы. Азот получают ректификацией жидкого воздухаю Предварительно охлажденный воздух переводят в жидкое состояние. Разделение компонентов воздуха основано на разнице температур кипения основных его газов.
Для сжижения воздуха необходимо сильное охлаждение. В промышленности: сжижение за счет процесса расширения сжатого воздуха с совершением внешней работы без теплообмена с окр средой.
В лаб. Усл. азот можно получить нагреванием нитрита аммония:
NH4NO2=N2+2H2O
Или смеси соли аммония с любым доступным нитритом:
NH4Cl+KNO2=N2+KCl+2H2O
Азот образуется при горении сухого аммиака
4NH3+3O2=2N2+6H2O
Или использовании аммиака в качестве восстановителя:
3CuO+2Nh3=3Cu+N2+3H2O
Валентные возможности 3, 4. Ст ок от -3 до +5
При комнатной температуре азот химически пассивен, реагирует лишь с литием и образует непрочные комплексы с солями d элементов. При повышенных температурах азот энергично взаимодействует со многими металлами, образуя нитриды.
6Li+N2=2Li3N
N2+3Mg=Mg3N2
Важнейшая реакция: N2+3H2=2NH3 (p,t,kat)
nB+n/2N2=(BN)n
CaC2+N2=CaCN2+C
Цианамид кальция как источник получения аммиака.
Ни один из оксидов не может буть получен прямым синтезом, а только косвенно. Соединения N2 и O2 с образованием NO Происходит при температурах свыше 5000 град, что технически невозможно реализовать. (разрадя мощной молнии) и то NO тут же превращается в NO2, который соединяясь с О2 и Р2Щ, в виде HNO3 попадает с каплями дождя в землю.
**
N2O: веселящий газ. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом.
Молекула N2O линейная, малополярная, её строение описывается наложением двух валентных схем:
N≡N(+)--O(-)↔N(-)=N(+)=O
Получение: Оксид азота (I) получают термическим разложением нитрата аммония при температуре около 200 °С:
NH4NO3 = N2O + 2H2O,
нагревание нужно проводить очень осторожно, перегрев и использование больших количеств нитрата может привести к взрыву.
Химические свойства: Оксид азота (I) не взаимодействует с водой. Несолеобразующий оксид. Проявляет окислительные свойства, в нем, как и в кислороде, вспыхивает тлеющая лучина и ярко горит сера.
При нагревании выше 600 °С разлагается со взрывом:
2N2O = 2N2 + O2.
Взаимодействует с водородом:
N2O + H2 = N2 + H2O.
При поджигании смеси оксида азота (I) и аммиака происходит взрыв:
3N2O + 2NH3 = 4N2 + 3H2O.
При взаимодействии с сильными окислителями проявляет восстановительные свойства:
5N2O + 2KMnO4 + 3H2SO4 = 10NO + 2MnSO4 + K2SO4 + 3H2O.
NO: несолеобразующий оксид азота. В нормальных условиях он представляет собой бесцветный газ, плохо растворимый в воде.
Молекула NO малополярная, линейная, её строение описывается двумя резонансными структурами. NO способен димеризоваться с образованием кристаллического соединения голубого цвета.
![]()
Получение:
В лаборатории получают действием на медь разбавленной азотной кислоты:
3Cu + 8HNO3 = 2NO + 3Cu(NO3)2 + 4H2O.
В промышленности получают каталитическим окислением аммиака на платино-родиевом катализаторе при 700 °С:
4NH3 + 5O2 = 4NO + 6H2O.
В атмосфере образуется из простых веществ в грозовых разрядах:
N2 + O2 = 2NO.
3SO2+2HNO3+2H2O=2NO+3H2SO4
2NaNO2+2NaI+2H2SO4=2NO+I2+2Na2SO4+2H2O
Химические свойства: Оксид азота (II) не взаимодействует с водой. Несолеобразующий оксид. Проявляет восстановительные свойства.
Он легко окисляется кислородом:
2NO + O2 = 2NO2.
С галогенами:
2NO+Gal2=2NOGal
При нагревании многие вещества восстанавливают NO до N2, или реже-до N2O^
2NO+C=CO2+N2
2NO+S=N2+SO2
2NO+SO2=N2O+SO3
2NO + 2CO = 2CO2 + N2 (родиевый катализатор)
Взаимодействует с перманганатом калия в кислой среде:
5NO + 3KMnO4 + 2H2SO4 = 2MnSO4 + 3KNO3 + Mn(NO3)2 + 2H2O.
Не реагирует с кислотами, при взаимодействии с расплавленной щелочью диспропорционирует:
6NO + 4KOH = N2 + 4KNO2 + 2H2O.
Кач реакция:
[Fe(H2O)6]SO4+NO=[Fe(H2O)5NO]SO4+H2O
N2O3: жидкость сине-зеленого цвета. Крайне неустойчивое соединение
Молекула N2O3 плоская и состоит из фрагментов ON – NO2 c непрочной связью N – N. У атома азота имеется неподеленная пара электронов. Твердый оксид азота (III) – ионное соединение.
![]()
Получение:
4Ag+6HNO3(конц)=4AgNO3+N2O3+3H2O
NO+NO2↔N2O3
2H2O+2HNO3+As2O3=2H3AsO4+N2O3
обезвоживании азотистой кислоты:
NaNO2 + H2SO4 = NaHSO4 + HNO2;
2HNO2 = N2O3 + H2O.
Химические свойства: Оксид азота (III) – типичный кислотный оксид, взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O = 2HNO2.
При взаимодействии со щелочами образуются соли азотной кислоты – нитриты:
N2O3 + 2NaOH = 2NaNO2 + H2O.
NO2 – бурый ядовитый газ.
Молекула NO2 имеет угловую форму, предполагается, что атом азота находится в состоянии sp2-гибридизации, длина связи N – O равна 0,119 нм, что соответствует полуторной связи.
![]()
NO2
На атоме азота имеется неспаренный электрон, поэтому он легко димеризуется с образованием димера N2O4. Молекула N2O4 плоская и состоит из фрагментов 2ON – NO2 c непрочной связью N – N.
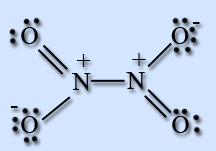
N2O4
