
- •7. *Общая характеристика и химические свойства германия, олова и свинца.
- •8.* Общая характеристика и химические свойства азота.
- •Получение
- •Химические свойства
- •Химические свойства
- •9. *Общая характеристика и химические свойства фосфора его получение в промышленности.
- •10. *Общая характеристика и химические свойства мышьяка, сурьмы и висмута.
- •11. Получение кислорода и пероксида водорода в промышленности и в лаборатории.
- •12. *Общая характеристика и химические свойства серы, селена и теллура.
- •13. Получение водорода в промышленности.
- •14.* Общая характеристика и химические свойства галогенов.
- •14. Фториды ксенона
- •15. Общая характеристика и свойства меди, золота, серебра
- •16. Общая характеристика и химические свойства элементов подгруппы цинка.
- •17. Общая характеристика и химические свойства подгруппы скандия.
- •18. Общая характеристика и химические свойства металлов подгруппы титана.
- •19. Общая характеристика и химические свойства элементов подгруппы ванадия.
- •20.* Общая характеристика и химические свойства хрома, молибдена и вольфрама.
- •21.* Общая характеристика и химические свойства марганца, технеция и рения.
- •22. Общая характеристика и химические свойства железа, кобальта и никеля.
- •23. Общая характеристика и химические свойства платиновых металлов.
- •24. Получение железа, никеля, хрома в промышленности.
- •25. Пирометаллургические способы получения металлов (свинец, медь, цинк) из сульфидных руд
- •26.Окислительное действие нитрата калия и хлората калия при нагревании (сплавлении).
- •27. Образование аммиакатов и гидроксокомплексов металлов и их разрушение кислотами и при нагревании.
- •28. Реакции термического разложения некоторых кислых солей ( NaHco3, NaH2po4, Na2hpo4, NaHso4).
Получение
В лаборатории образуется при взаимодействии меди с горячей концентрированной азотной кислотой:
Cu + 4HNO3к = Cu(NO3)2 + 2NO2 + 2H2O;
при термическом разложении высушенных нитратов тяжелых металлов:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
В промышленности окисление оксида азота (II) кислородом:
2NO + O2 = 2NO2,
реакция является обратимой.
Химические свойства
Оксид азота, и мономер, и димер, хорошо растворим в воде, и взаимодействует с ней:
2NO2 + H2O = HNO3 + HNO2,
при этом происходит диспропорционирование на азотную и азотистую кислоты.
При температуре выше 0 °С реакция протекает по другому:
3NO2 + H2O = 2HNO3 + NO.
Если через воду пропускать смесь оксида азота (IV) и воздуха, то образуется только азотная кислота:
4NO2 + 2H2O + О2 = 4HNO3.
Диоксид азота – сильный окислитель, в его атмосфере горят углерод и сера:
С + 2NO2 = CO2 + 2NO;
S + 2NO2 = SO2 + 2NO.
10NO2+6P=3P2O5+5N2O
4Mg+2NO2=4MgO+N2
N2O5 — бесцветные, очень летучие кристаллы. Крайне неустойчив.
Оксид азота (V) – ангидрид азотной кислоты, построен из ионов NO2+ и NO3-, в газовой фазе и растворе состоит из молекул N2O5.
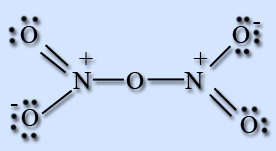
Получение
2HNO3к+ P2O5 = N2O5 + 2HPO3
2NO2 + O3 = N2O5 + O2.
Химические свойства
Разложение:
2N2O5 = 4NO2 + O2.
При растворении в воде образует азотную кислоту:
N2O5 + H2O = 2HNO3.
Является сильным окислителем:
N2O5 + I2 = I2O5 + N2.
Аммиа́к — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине.
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N2 + 3H2 ↔ 2NH3
Это так называемый процесс Габера
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑ + NaCl + H2O.
NH4NO3 + NaOH = NH3↑ + NaNO3 + H2O.
1. Реакции присоединения:
а) С водой: (реакция обратимая»)
NH3 + H2O = NH3*H2O
или NH3 + H2O = NH4OH
б) С кислотами:
NH3 + HCl = NH4Cl
NH3 + H2SO4 = NH4HSO4
2 NH3 + H2SO4 = (NH4)2SO4
в) С кислыми солями аммония (превращает в средние)
NH3 + NH4H2PO4 = (NH4)2HPO4
NH3 + NH4HSO4 = (NH4)2SO4
2. С кислородом:
4NH3 + 3О2 = 2N2 + 6H2O
4NH3 + 5О2 = 4NO + 6H2O
3. C хлором:
NH3 + 3Cl2 = 2N2 ↑ + 6HCl
4. С оксидом меди (II):
3CuO + 2 NH3 = 3Cu + N2 ↑ + 3H2O
5. C металлами:
2NH3 + 2Al = 2AlN +3H2
6. С углекислым газом
2 NH3 + CO2 = H2O + CO(NH2)2
7. Реакция разложения:
2 NH3 = N2 + 3H2
Гидрази́н (диамид) H2N—NH2 — бесцветная, сильно гигроскопическая жидкость с неприятным запахом. Ядовитый.
Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO:
NH3 +
NaClO ![]() NH2Cl
+ NaOH
NH2Cl
+ NaOH
NH2Cl + NH3 N2H4 · HCl,
Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману:
H2NCONH2 + NaOCl + 2 NaOH N2H4 + H2O + NaCl + Na2CO3,
реакция проводится при температуре ~100 °C и атмосферном давлении.
В целом гидразин характеризуется восстановительными свойствами:
N2H4+O2=N2+2H2O (t)
2N2H4+4KMnO4+6H2SO4=5N2+4MnSO4+K2SO4+16H2O
Только очень сильные восстановители способны восстановить его до N(-3)
N2H4+Mg+4HCl=MgCl2+2NH4Cl
****ТЕРМИЧЕСКОЕ РАЗЛОЖЕНИЕ СОЛЕЙ АММОНИЯ: NH4NO3=N2O+2H2O (250°)
2NH4NO3=2N2+O2+2H2O (400°)
NH4NO2=N2+2H2O (t)
(NH4)2Cr2O7=N2+Cr2O3+4H2O (t)
NH4Cl=NH3+HCl (t)
(NH4)2SO4=2NH3+H2SO4 (t)
*****Гидроксиламин (NH2OH) –кристаллическое ядовитое вещество, проявляющее преимущественно восстановительные свойства.
Получение: электрохимиичекски врсстанавливают раствор азотной кислоты, на катоде суммарно происходит реакция: HNO3+ 6H++6е= NH2OH+2H2O
Свойства:
NH2OH+2KMnO4+9H2SO4=5N2+2MnSO4+K2SO4+18H2O
2NH2OH+I2+2KOH=N2+2KI+4H2O
Промежуточная степень окисления атома азота объясняет диспропорционирование этого соединения при нагревании и способность восстанавливаться до иона NH4+
3NH2OH=N2+NH3+3H2O(t)
4KI+2NH2OH+3H2SO4=2I2+(NH4)2SO4+K2SO4+2H2O
NH2OH+HCl=[NH3OH]Cl
Азотистый водород (в растворе-азотистоводородная кислота) может быть получена следующим образом:
N2H4+HNO2=HN3+H2O
Соль этой кислоты-азид натрия-получают так:
2NaNH2+N2O=NaN3+H2O (200°)
Как окислитель HN3 в растворе имеет черты сходства с азоткой, например:
Cu+3HN3=Cu(N3)2+N2+NH3
Азиды щелочные и щелочноземельных металлов плавятся не разлагаясь и хорошо растворимы в воде, азиды тяжелых металлов при нагревании и даже от удара взрываются.
******ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С АЗОТНОЙ КИСЛОТОЙ
Кислота |
концентрация |
Продукты реакции кислот с металлами |
|||
|
|
K,Ba,Ca,Na,Mg |
Al,Cr,Fe |
Zn,Sn |
Cu,Hg,Ag |
Азотная |
Разбавленная |
Соль+NH3+H2O |
Соль+NO+H2O |
Соль+NO+H2O |
Соль+NO+H2O |
|
концентрированная |
Соль+N2O+H2O |
Пассив. металла |
Соль+NO2+H2O |
Соль+NO2+H2O |
*******Смесь 3 объемов концентрированной соляной и 1 объема азотной кислоты называют «царской водкой». Это название отражает тот факт,что указанная смесь растворяет «царя металлов»- золото:
Au+4HCl+HNO3=H[AuCl4]+NO+2H2O
3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO+8H2O
3HgS + 8HNO3(конц.) + 6HCl(конц.) = 3HgCl2+ 3H2SO4 + 8NO↑ + 4H2O
********Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
2NaNO3 = 2NaNO2 + O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
2AgNO3 = 2Ag + 2NO2 + O2
г) нитрат аммония:
NH4NO3 = N2O + 2H2O
