
- •1.Химический состав нефти
- •2.Химическа классификация нефтей
- •3.Ароматические углеводороды в нефтях,их значение как компанентов топлив и масел и как сырьё для органического синтеза
- •4. Пути изучения химического состава нефти. Методы фракционирования: перегонка, кристаллизация, экстракция, хроматография, термодиффузия, комплексобразование с мочевиной.
- •Фракционирование
- •Жидкостная термодиффузия
- •Кристаллизация
- •Хроматография жидких компонентов нефти
- •Хроматография на гелях
- •Спектральные методы анализа и идентификации
- •5. Изучение продуктов фракционирования на основании физических характеристик фракций.
- •Плотность
- •Показатель преломления
- •Удельная и молекулярная рефракции
- •Удельная дисперсия
- •Интерцепт рефракции
- •Химические реакции, применяемые для изучения состава углеводородов.
- •Действие серной кислоты.
- •Действие галоидов
- •Выделение олефинов с помощью полухлористой серы
- •Количественное определение олефинов методом кислородных чисел
- •Выделение непредельных углеводородов при помощи солей ртути
- •Идентификация алкенов с помощью реакции окисления
- •7.1 Озонирование:
- •7.2 Реакция исчерпывающего окисления:
- •Определение диолефинов при помощи малеинового ангидрида
- •Определение нафтеновых углеводородов
- •7. Методы выделения и идентификации алкенов , диенов, ароматических ,нафтеновых и алкановых ув.
- •8 Изучение химического состава ув нефти в виде ее отдельных фракций. Химический состав прямогонных бензинов
- •Химический состав керосино-газойлевых фракций
- •Нафтено-ароматические углеводороды
- •Химический состав вакуумных дистиллятов
- •9. Определение группового состава.
- •10. Анализ структурно-группового состава масел.
- •12.Химический состав масел и их эксплутационные свойства
- •13.Химический состав керосина и методы анализа его фракций
- •14. Детанационная характеристика топлив и мехонизм детонации
- •15. Кислородосодержащие соединения. Нафтеновые к-ты и их свойства. Области примменения
- •16. Строение нафтеновых к-т. Содержание их в нефти, нефтепродуктах, выделение и анализ. Применение нафтеновых к-т
- •17.Серосодержащие соединения нефти, их разновидности, физические и химические свойства
- •18. Качественный анализ сернистых соединений, количественное содержание в сернистых нефтях.
- •19. Групповой анализ сернистых соединений.
- •20. Влияние сернистых соединений на эксплуатационные и экологические свойства нефтепродуктов.
- •21. Смолисто-асфальтеновые вещества нефти и продуктов переработки, их классификация.
- •22. Характеристика состава и свойств отдельных групп сав.
- •Асфальтогеновые кислоты
- •Химическая природа смол
- •23. Содержание сав в нефтях и нефтепродуктах, их образование в процессах переработки нефти.
- •24. Влияние сав на свойства нефтепродуктов и катализаторы процессов глубокой переработки нефти.
- •25. Катализаторы и каталитические реакции в нефтепереработке. Классификация каталитических реакций. Активность, селективность и стабильность катализаторов.
- •26. Алкилирование изобутана бутиленами: тд процесса; механизм процесса; катализаторы; сырьё алкилирования; факторы, влияющие на процесс: т, с изобутана, контакт между фазами, р.
- •27. Полимеризация олефинов с целью получения компонента бензина: тд и механизм процесса; катализатор; факторы, влияющие на процесс: т, р, сырьё, объёмная скорость.
- •Превращения циклоалканов.
- •29.Изомеризация н.Парафиновых у/в…
- •34.Термический распад молекул на радикалы, энергия связи, энергия активации реакций деструктивного распада.
- •35.Реакции радикалов: замещение, присоединение, распад, изомеризация, рекомбинация, диспропорционирование.
- •36.Цепные реакции, терминология теории неразветвленных цепных реакций.
- •38.Применение оптических (спектральных) методов исследования в химии нефти для контроля за качеством сырья и промышленной продукции нефтепереработки и нефтехимии.
36.Цепные реакции, терминология теории неразветвленных цепных реакций.
Образовавшийся радикал при распаде или реакции с молекулой превращается в другой радикал; так происходит до тех пор, пока не произойдет столкновение двух радикалов, приводящее к их рекомбинации или диспропорционированию. Происходит ряд превращений одних радикалов в другие. Так как число радикалов, могущих образоваться в данной системе, невелико, на некоторой стадии образуется радикал, уже принимавший участие в одной из предыдущих стадий, и возникает регулярное чередование двух или нескольких последовательных элементарных реакций.
Этот процесс продолжается до тех пор, пока радикал не погибнет в результате реакций рекомбинации или диспропорционирования. Реакции такого типа называются цепными реакциями или цепными процессами.
Термины теории неразветвленных реакций.
Элементарная реакция, при которой радикалы образуются из молекулы (при мономолекулярном распаде) или молекул (при бимолекулярном диспропорционировании молекул на радикалы), называется реакцией инициирования цепи. Реакции превращения одних радикалов в другие, при которых расходуется исходное вещество, называются реакциями продолжения цепи. Реакции, при которых радикалы гибнут, превращаясь в стабильные молекулы в результате рекомбинации или диспропорционирования, называются реакциями обрыва цепи. Если реакция радикала с молекулой приводит к образованию малоактивного радикала, который практически вступает только в реакции диспропорционирования и рекомбинации, то реакцией обрыва цепи является реакция образования этого радикала. При рекомбинации и диспропорционировании радикалов скорость реакции обрыва цепи пропорциональна квадрату концентрации радикалов, и такой обрыв цепей называется квадратичным. При обрыве цепей в результате образования малоактивных радикалов, не способных к реакциям продолжения цепи, скорость обрыва пропорциональна концентрации радикалов в первой степени, и такой обрыв называется линейным.
Совокупность элементарных реакций продолжения цепи, повторение которых дает цепной процесс, называется звеном цепи.
В одном звене цепи расходуется одна молекула исходного вещества. Поэтому число молекул, расходующихся в результате образования в стадии инициирования радикала, равно числу звеньев цепи, называемому длиной цепи. Длина цепи v равна отношению скорости реакции w, выраженной в молекулах, образовавшихся за единицу времени, к скорости инициирования цепей wиниц, выраженной в радикалах, образующихся в стадии инициирования цепей в единицу времени.
Длина цепи определяется соотношением скоростей реакций продолжения и обрыва цепей. Рассмотрим в качестве иллюстрации термический распад этана.
В результате распада молекулы этана по слабейшей связи образуются метильные радикалы:
С2Н6 —► 2СН3• (I)
Метильный радикал при реакции с молекулой этана превращается в этильный:
СН3• + С2Н6 —► СН4 + С2Н5. (2)
Этильный радикал распадается:
С2Н5• —► С2Н4 + Н (3)
При реакции атома водорода с молекулой этана регенерируется этильный радикал:
Н + С2Н6 —Н2+C2H5•. (4)
Чередование элементарных реакций (3) и (4) дает реакцию распада этана по стехиометрическому уравнению:
С2Н6=С2Н4 + Н2
Чередование реакций (3) и (4) может оборваться при реакциях:
2С2Н5• —► С4Н10(С2Н6+С2Н4) (5)
С2Н5• + Н —► С2Н6 (С2Н4 + Н2) (6)
2Н + С2Н6 —► Н2 + С2Н6 (7)
Реакция (1)— реакция инициирования цепи. Неповторяющаяся реакция продолжения цепи (2) называется, для отличия от повторяющихся реакций продолжения цепи (3) и (4), реакцией передачи цепи. Совокупность реакций (3) и (4) является звеном цепи. Реакции (5)—(7)—реакции квадратичного обрыва цепи.
37.Пиролиз, назначение процесса и характеристика продуктов: химизм процесса пиролиза; превращение алканов, циклоалканов, алкенов и ареновых углеводородов; пиролиз сложных углеводородных смесей; правило аддитивности; образование пироуглерода; основы управления процессом пиролиза (температура, давление, время реакции, сырье).
Современная нефтехимическая промышленность производит широкий ассортимент продуктов: пластмассы, синтетические волокна, растворители и т.д. Важнейшим сырьем для них являются низшие алкены – этилен, пропилен, бутилены, бутадиен, а также ароматические углеводороды – бензол, толуол, ксилол.
Одним из основных нефтехимических процессов производства низших олефинов, в частности, этилена, является пиролиз.
Неуклонный рост производства получаемых на основе этилена продуктов – полиэтилена, оксида этилена, винилхлорида, этилового спирта, стирола и др. обуславливает существенный рост производства этилена.
Сырьё пиролиза
Следует различать четыре основные группы сырья пиролиза:
Этан, пропан, бутан и их смеси, выделяемые из природных и попутных газов;
Прямогонные и смешанные нефтяные фракции типа бензинов с концом кипения 200°С, плотностью до 0,73 г/см3;
Тяжелые дистилляты с концом кипения примерно 380°С;
Нефтяные остатки и сырые нефти.
Промышленный процесс пиролиза ведется в сторону ужесточения условий его ведения. Во избежание усиленного коксообразования и смолообразования время контакта должно быть снижено с 0,5–1 с. до 0,1–0,4 с. Для поддержания низкого парциального давления углеводородов в реакционную камеру подают инертный разбавитель, например, водяной пар, снижающих отложение кокса на стенках реакционных труб печей пиролиза. В условиях «жесткого» пиролиза выход этилена больше на 5–7% по сравнению с обычным пиролизом, т.е. примерно 30–35%мас. Увеличение выхода продукта приводит к экономии сырья, которое является во многих странах дефицитом, и к снижению стоимости производства этилена.
Продукты пиролиза
Водородная фракция – увеличивается спрос на продукт повышенной чистоты – более 90%об водорода.
Метановая и водородная фракции. Вследствие практически полного отсутствия серы стремятся использовать фракции в качестве сырья для получения водорода процессом паровой конверсии вместо сжигания в качестве топлива.
Ацетилен – должен вырабатываться чистотой не ниже 99,8%об.
Этилен – наряду с сортом «полимеризационный» существует спрос и на менее чистый продукт для производства этилбензола.
Пропилен – до недавнего времени производство пропилена удовлетворяло спрос на него. В последнее время наметился дефицит пропилена в связи с ростом производства важнейших продуктов из него: полипропилена, бутиловых спиртов (методом оксосинтеза), акрилонитрила и др.
Бутадиен, получающийся при пиролизе, используется главным образом для производства различных полимерных материалов.
Пиробензин – наряду с широкой фракцией существует спрос и на узкую фракцию (С5) с высоким содержанием изопрена и циклопентадиена.
Одним из побочных продуктов является легкая смола. Из нее могут быть получены ароматические углеводороды (бензол, ксилол, стирол, толуол и др.). Эти углеводороды – важные исходные вещества для производства ценных продуктов.
Химизм процесса пиролиза
Химические превращения углеводородов в ходе пиролиза можно условно разделить на две категории: первичные и вторичные. В результате первичных реакций образуются алкены этилен, пропилен, бутилен, бутадиен. В ходе вторичных реакций алкены и диеновые углеводороды подвергаются реакциям конденсации, полимеризации с одновременным более глубоким разложением, в результате чего образуются ароматические углеводороды: бензол, нафталин, дифенил, более конденсированная ароматика. Кроме того, в ходе процесса образуются кокс и сажа.
В связи с объемом мощностей этиленовых агрегатов необходимо учитывать влияние состава сырья на выход продуктов пиролиза.
Превращения парафиновых углеводородов в процессе пиролиза. Парафины н.–строения при пиролизе дают Н2, СН4, этилен, пропилен и т.д., т.е. идет реакция крекинга по радикальному нецепному механизму, сопровождающаяся дегидрогенизацией и диспропорционированием водорода.
Распад алканов может происходить по всем связям С–С. Чем выше температура и ниже давление, тем место разрыва углеродной цепи все больше смещается к ее концу, и значительно возрастает выход газообразных продуктов. Одновременно характерна и реакция дегидрирования и диспропорционирования водорода.
В качестве примера рассмотрим превращения, протекающие при пиролизе н-гексана С6Н14.
Первичные реакции: 2. Вторичные реакции:


Распад длинных радикалов протекает по связи в β-положении к свободной валентности углеводорода:

При
этом образуются алкены, и регенерируются
радикалы .
Начальными продуктами пиролиза н-гексана
должны являться: водород, метан, этан,
этилен, пропилен, бутены и пентан.
.
Начальными продуктами пиролиза н-гексана
должны являться: водород, метан, этан,
этилен, пропилен, бутены и пентан.
При увеличении молярной массы сходных по строению парафиновых углеводородов выходы этилена и пропилена уменьшаются, а выходы тяжелых и жидких углеводородов растут (таблица 1).
Выход пропилена и этилена зависит от количества разветвлений в молекуле исходящего парафинового углеводорода. Так, если сравнивать углеводороды одной молярной массы, то при пиролизе С7Н16 выход этилена тем ниже, чем больше разветвлений в исходной молекуле.
Такая же закономерность имеет место и для октана С8Н18. Таким образом, разветвление цепи парафиновых углеводородов снижает выход этилена и повышает выход пропилена, причем тем больше, чем больше разветвлений.
Если же сравнивать н-октан, 4-метилгептан, 3-этилгексан, отличающиеся друг от друга отсутствием разветвления, наличием метильной и этильной групп в центре молекулы, то можно отметить, что на выход продуктов пиролиза влияет и характер разветвления. Замена метила на этил увеличивает выход метана и дивинила, но уменьшает выход этилена и пропилена:
Наиболее подробно изучены закономерности термического разложения углеводородов в условиях термического крекинга (теория Райса) существенно изменяются при переходе от условий термического крекинга к условиям пиролиза.
Теория Райса предполагает существование длинных радикальных цепей, что действительно имеет место в условиях термического крекинга, проводимого при температуре 450–550°С.
Установлено, что с увеличением температуры до 800–1000°С увеличивается концентрация радикалов, в которых β-расщепление С–С связей преобладает над передачей цепей другим молекулам.
Для более точного совпадения расчетных и экспериментальных данных сделано допущение, что наряду с β-расщеплением радикалов по С–С связи имеет место α-расщепление С–С связей (≈ 1/5 всех радикалов), а также 2/3 образующихся н-пропильных радикалов стабилизируется расщеплением С–Н связей, т.е. за счет передачи водорода другим радикалам.
Превращения непредельных углеводородов в процессе пиролиза. В сырье пиролиза ненасыщенные углеводороды отсутствуют, но роль их в химии пиролиза велика, т.к. они всегда образуются при распаде углеводородов других классов. Олефины при низких температурах и высоких давлениях полимеризуются, но чем выше температура и ниже давление, тем более равновесие смещается в обратную сторону (влево).
↔ (CnH2n)n
(CnH2n)n
Анализ энергетических особенностей молекулы олефина показывает, что наименьшей энергией диссоциации обладает связь С–С, находящаяся в β-положении по отношению к двойной связи:

С–С–С–С=С
γ α
β – правило определяет наиболее вероятное место распада в углеводородной цепи. Отметить необходимо и то, что в различных реакциях отрыв водорода от атома углерода легче идет от β-углерода.
а) Из этилена в условиях пиролиза получается дивинил и водород:СН2 = СН2 → СН2 = СН + Н (1)
Связь С=С прочнее связи С–Н, поэтому образуются радикалы винила и водорода.
СН2 = СН2 + СН2 = СН → СН2 = СН + СН2 = СН2 (2)
СН2 = СН2 + Н → СН2 = СН + Н2 (3)
В результате соударения виниловых радикалов образуется дивинил, или суммарно:
СН2 = СН2 + СН2 = СН2 → С4Н6 + Н2 (4)
б) Из пропилена и бутилена получается смесь алкана, алкена и алкадиена:СН3 – СН = СН2 → СН2 = СН + СН3
СН3
– СН = СН2
+
 Н
= СН2
→ СН2
= СН2
+
Н2
– СН = СН2
Н
= СН2
→ СН2
= СН2
+
Н2
– СН = СН2
т.к. связь С–С и связь С–Н менее прочна, чем связь С=С
СН3 – СН = СН2 + СН3 → СН4 + Н2 – СН = СН2
аллильный
радикал
Н2 – СН = СН2 + Н2 – СН = СН2 → СН2 = СН – СН2 –СН2 – СН = СН2
диаллил
Суммарно:
3С3Н6 → СН4 + СН2 = СН2 + С6Н10
Радикально-цепной механизм термического разложения изобутана:
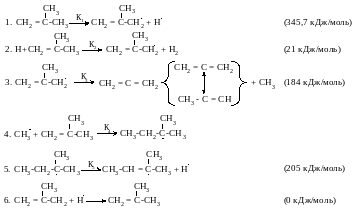
Инициирование по реакции (1) более вероятно, чем по реакции:

Энергия диссоциации разрывающейся связи С–С в данном случае выше 97кДж/моль.
Суммарная реакция:
2С4Н8 → Н2 + С3Н4 + С5Н10
В продуктах пиролиза происходит сдвиг к олефинам меньшей молярной массы. При глубоких степенях превращения имеют место радикальные реакции отрыва водорода от олефинов, в которых образуются винильные, аллильные и другие ненасыщенные радикалы.
Они являются источниками бутадиена и ароматических углеводородов. Эти вторичные реакции играют второстепенную роль в начальный период разложения из-за низкой концентрации олефиновых углеводородов, но с повышением степени разложения вторичные реакции протекают быстрее, чем первичные, что и объясняет наличие максимума на кривой выхода олефинов.
При температуре выше 700°С диолефины весьма склонны к уплотнению путем полимеризации (1) и конденсации с алкенами (2) с образованием циклических углеводородов:
 Реакция
диенового синтеза (2) – один из главных
путей образования ароматических
углеводородов. В условиях пиролиза
весьма вероятна реакция конденсации
ароматических углеводородов с алкадиенами
– источник образования тяжелых продуктов
пиролиза.
Реакция
диенового синтеза (2) – один из главных
путей образования ароматических
углеводородов. В условиях пиролиза
весьма вероятна реакция конденсации
ароматических углеводородов с алкадиенами
– источник образования тяжелых продуктов
пиролиза.

Превращения нафтеновых и ароматических углеводородов. Для расщепления нафтеновых углеводородов в условиях пиролиза характерным является повышенный выход дивинила.
Основными реакциями разложения циклогексана при 700–800°С и τ = 0,5 – 1,5с. являются дегидрирование кольца с одновременным его разрывом, в результате чего главными продуктами его разрыва являются этилен, водород, пропилен и дивинил:
 ,
,
Бициклические нафтены также подвергаются дециклизации, крекингу и дегидрированию.

На состав продуктов пиролиза нафтеновых углеводородов влияет количество разветвлений в исходном сырье (таблица 3). На ряд нафтеновых углеводородов распространяется вывод о роли числа разветвлений, справедливый для парафиновых углеводородов.
С увеличением числа разветвлений в нафтеновых углеводородах снижается выход этилена и повышается выход пропилена, кроме того, закономерно увеличивается выход бутадиена.
При пиролизе алкилароматических углеводородов единственной первичной реакцией является реакция деалкилирования. Это подтверждается высоким содержанием ароматических углеводородов в смоле (99,5%).Так, при пиролизе этилбензола получается только 5,13% масс. этилена, 0,22% пропилена, 0,05 % дивинила, т.е. при пиролизе ароматических углеводородов выход этилена очень мал, пропилен и бутилен почти не образуется. Ароматическое кольцо остается неизменным.
Суммарные реакции превращения углеводородов при пиролизе имеют первый кинетический порядок.
Теплоты реакций пиролиза: 3 775 кДж/кг для этана; 1 130 кДж/кг для бензина.
Важным выводом, сделанным И.В.Калечиц, Т.Н.Мухиной является правило аддитивности: в условиях высоких температур каждый углеводород будет подвергаться расщеплению в основном независимо от других углеводородов, превращение смеси углеводородов будет суммой превращений ее компонентов.
Зная основные закономерности превращений углеводородов содержащихся в сырье пиролиза, правило аддитивности открывает возможность предсказывать выходы основных продуктов пиролиза.
Сложные углеводородные смеси.
Скорости термического разложения различных индивидуальных углеводородов могут очень сильно варьировать. При разложении смесей скорости реакции различных углеводородов смеси сближаются.
Молекулярные реакции протекают независимо друг от друга. Цепные же реакции, протекающие в данной системе, всегда взаимосвязаны и, как правило, имеют общие стадии инициирования и обрыва цепей. Если термическому разложению подвергается смесь углеводородов А, В, С, D, ... и углеводород А распадается на радикалы с большей скоростью, чем другие углеводороды, то скорость инициирования цепей для всех углеводородов в смеси равна kа[А].
Если при взаимодействии ведущих цепь радикалов с углеводородом В образуются неактивные радикалы В•, способные только к рекомбинации, и скорость гибели активных радикалов при этом больше, чем при других реакциях (рекомбинации и диспропорцио-нирования), то скорость обрыва цепей для всех углеводородов в смеси равна kn[R•] [В]. Соотношение скоростей разложения различных углеводородов в смеси равно соотношению констант скоростей реакций радикалов, ведущих цепь, с данными углеводородами. Соотношение констант скоростей реакций данного радикала с различными углеводородами определяется главным образом значениями энергии активации, так как значения предэкспоненциальных множителей близки. Цепи в газофазных термических реакциях развиваются устойчивыми относительно распада активными радикалами СН3•, С2Н5•, С6Н6- и атомами водорода. Реакции этих радикалов с различными углеводородами, которые могут находиться в нефтяных смесях, различаются энергиями активации (для различных углеводородов) в пределах 21 кДж-моль-1, что для обычных при пиролизе температур соответствует различию в константах скоростей в пределах одного порядка.
Это значительно меньшее различие, чем между скоростями термического разложения индивидуальных углеводородов. Из углеводородов нефтяных фракций слабейшие связи, по-видимому, содержат арены; связи типа С6Н5СН2—R имеют в зависимости от вида R прочность 250—300 кДж-моль-1.
При наличии в углеводородной смеси метилзамещенных аренов наиболее вероятен обрыв цепей в результате образования бензилоподобного радикала при реакциях типа
R • + СН3С6H4R' —► RH + R'C6H4•CH2
Энергия активации такой реакции ≈30 кДж-моль-1. Реакции радикалов с углеводородами имеют энергию активации 30— 40 кДж-моль-1, следовательно, эффективная энергия активации термического разложения нефтяной фракции должна быть (250 - 300)+ (30 - 40)— 30 = 250 - 310 кДж-моль-1.
Если исходная смесь углеводородов не содержит алкано-аренов, имеющих связи С—С, сопряженные с ареновым кольцом, то инициирование цепей при образовании небольших количеств алке-нов C4 и выше происходит с такой же скоростью, так как прочность связей С—С, сопряженных с π-связью, в алкенах практически такая же, как в алкано-аренах.
В случае термического разложения этилена при температурах когда распад винильного радикала по реакции
СН2=•СН —► СН==СН + Н.
несуществен, этилен расходуется в результате реакции:
СН2=•СН + СН2=СН2 —► СН2=СНСН2•СН2 —► Продукты
При крекинге этилена в смеси с другими углеводородами виниль-ный радикал может стабилизоваться в этилен по реакции:
СН2=•СН + RH —► СН2=СН2 + R •
При kd[RH] >> kC[C2H4] этилен не расходуется.
В смеси с другими углеводородами в некоторых случаях может существенно изменяться состав продуктов термического распада данного углеводорода. Например, толуол в чистом виде дает при термическом распаде в основном продукты конденсации. При термическом разложении в смеси с другими углеводородами бензиль-ный радикал при реакциях с алкенами легко превращается в толуол
С6Н5•СН2 + СН2 = CHCH2R —► С6Н5СН3 + СН2 = CH•CHR ± 0 кДж•моль-1 и конденсация подавляется. Реакция в этом случае приводит к преимущественному деметилированию толуола.
Пропен при термическом разложении в смесях дает больший выход этилена, чем при термическом разложении в чистом виде, так как в результате реакций типа
C3H5• + ArCH2R —► С3Н6 + Ar•CHR
С3Н5 • + CH2=CHCH2R —► C3H6 + CH2CH•CHR
подавляется рекомбинация аллильных радикалов и реакции присоединения их по π-связи, приводящие к образованию продуктов конденсации.
Образование пироуглерода
При газофазном термическом разложении углеводородов наряду с гомогенными реакциями в некоторой степени протекает реакция с образованием твердого вещества, содержащего 99 % и более углерода, — пироуглерода. Хотя относительно баланса процесса образование пироуглерода обычно несущественно, технологически эта реакция весьма важна. Отложение пироуглерода на стенках реакционных труб печей пиролиза сильно снижает общий коэффициент теплопередачи к реагирующей смеси, так как коэффициент теплопроводности пироуглерода на два порядка меньше, чем для стали, и повышает гидравлическое сопротивление змеевика. Образование дисперсного пироуглерода в газовом объеме — сажи — сильно затрудняет разделение продуктов процесса. На твердой поверхности пироуглерод обычно выделяется в виде плотной, с металлическим блеском пленки, воспроизводящей все детали поверхности. Образование этого вида пироуглерода подчиняется следующим закономерностям.
Отложение пироуглерода на различных материалах происходит при данных условиях с различной скоростью. После покрытия поверхности, на которой идет отложение пироуглерода, слоем некоторой толщины скорость выделения пироуглерода во многих случаях становится независимой от природы подложки, так как углерод отлагается на углероде, и прямо пропорциональна поверхности. Влияние материала подложки проявляется для разных материалов при различных толщинах пироуглеродной пленки. Так, для платины стационарная скорость выделения пироуглерода, равная скорости выделения его на пироуглероде, достигается при толщине пленки (7-8)-10-7 см, на кварце — при толщине пленки (1,5 - 2)- 10-5 см, для хромоникелевой стали скорость выделения пироуглерода еще несколько выше стационарной при толщине пленки даже (1,5- 2)-10-3 см, что связано с диффузией атомов металлов в пироуглероде, проходящей, видимо, химическим путем по мере роста слоя пироуглерода.
Скорость образования пироуглерода обратно пропорциональна парциальному давлению водорода в степени 0,5. Из расчета по экспериментальным данным следует, что энергия активации распада углеводородной молекулы на элементы Е = 42— 48 кДж-моль-1. Такое низкое значение энергии активации соответствует тому, что молекула реагирует с активным центром углеродной поверхности как со свободным радикалом.
Так как разница в скоростях разложения до элементов для различных углеводородов относительно невелика, газофазные реакции углеводородов влияют на скорость отложения пироуглерода незначительно.
Основы управления процессом пиролиза
Факторами, которые можно в определенных пределах задавать, влияя на результаты пиролиза, являются температура, давление, время реакции и качество сырья.
Температура.
Для реакций первого порядка, механизм которых не изменяется с изменением температуры, время реакциий, необходимое для достижения заданной ее глубины, изменяется с изменением температуры согласно уравнению:
τ1/τ2 = k2/k1=eE/R
Для реакций других порядков это уравнение справедливо при постоянстве начальной концентрации.
При энергии активации пиролиза 270 кДж-моль-1 повышение температуры от 600 до 700 °С снижает время достижения заданной степени превращения в 46 раз, от 700 до 800 °С — в 22 раза и от 800 до 900°С — в 13 раз.
Увеличение температуры снижает селективность радикалов при реакциях замещения, что повышает образование первичных радикалов и снижает роль изомеризации первичных радикалов во вторичные, так как распад идет с большей энергией активации, чем изомеризация, и при увеличении температуры ускоряется в большей степени. Это также приводит к увеличению выхода этилена. Верхний предел температуры пиролиза определяется превращением этилена в ацетилен. Давление.
Повышение давления при данной температуре снижает долю радикалов С2Н5•, изо-С3Н7•, трет-С4Н9•, распадающихся на алкен и атом водорода, и соответственно повышает роль реакций замещения для этих радикалов, в результате снижаются выходы низших алкенов и водорода и возрастают выходы этана, пропана, изо-бутана. Компенсация повышения давления повышением температуры практически невозможна. Разница в энергиях активации распада и замещения =140 кДж-моль-1. Для получения высокого выхода этилена при пиролизе требуется высокая температура и соответственно малое время реакции. При пиролизе в трубчатых печах малое время реакций, требующих больших скоростей сырьевого потока, достигается при преодолении значительных гидравлических сопротивлений. В результате создается повышенное давление на входе в реакционный змеевик. Применяется разбавление углеводородного сырья инертным разбавителем, чем обеспечивается необходимое общее давление при низком парциальном давлении углеводородов. В качестве инертного разбавителя применяют водяной пар, который легко отделяется от продуктов пиролиза конденсацией. Кроме того, водяной пар в некоторой степени снижает отложение пироуглерода в результате его газификации по реакции Н2О + С = Н2 + СО.
Обычно применяемые массовые соотношения пар: сырье составляют (в кг/кг) для этана — 0,25 - 0,35, пропана — 0,30 - 0,40, бутана — 0,40 - 0,50, бензина — 0,50 - 0,80, атмосферного газойля — 0,80- 1,00.
Время реакции.
Пиролиз является совокупностью последовательных реакций, при которых целевые продукты (этилен и пропен) образуются при распаде как исходного сырья, так и первичных продуктов его разложения, и также подвергаются разложению. Поэтому важно обеспечить время реакции, соответствующее максимальному выходу целевого продукта.
Максимальный выход этилена достигается при равенстве скоростей его образования и расходования, при дальнейшем увеличении времени реакции выход его снижается.
Следовательно, степень пиролиза х, соответствующая максимальному выходу этилена, не зависит от температуры и определяется свойствами сырья.
Сырье.
Нормальные алканы дают при пиролизе наибольший выход этилена. Максимальный выход этилена дает пиролиз этана, в ряду этан > пропан > бутан выход этилена снижается. При дальнейшем увеличении числа атомов углерода в молекуле алкана выход основных продуктов пиролиза меняется мало.
Алканы изостроения дают меньшие выходы этилена при пиролизе, чем неразветвленные; снижение выхода этилена тем больше, чем более разветвлен углеводород. Незамещенные арены при пиролизе остаются неизменными, из метилзамещенных может образоваться единственный газообразный продукт — метан, арены с двумя и более атомами углерода в алкильном заместителе распадаются в значительной степени на стирол и газообразные продукты.
Метилзамещенные арены тормозят цепной процесс вследствие образования малоактивных бензильных радикалов, а арены, имеющие сопряженную с кольцом слабую связь С—С, при значительной концентрации могут ускорять инициирование цепей.
С утяжелением фракционного состава сырья выход метана снижается, а выход этана практически неизменен. Выход этилена, наибольший для фракции 30—60 °С, резко снижается при пиролизе фракции 60—85 СС, содержащей непиролизуемый бензол и дающий малый выход этилена циклогексан. Далее он медленно снижается в соответствии с увеличением содержания во фракциях аренов, а для фракций, перегоняющихся выше 250СС, снова резко снижается в результате значительного содержания в них конденсированных циклоалканов и гибридных углеводородов, содержащих конденсированные ареновые и циклоалкановые кольца. Выход жидких углеводородов и пироуглерода с утяжелением фракционного состава сырья возрастает.
