
- •Часть I
- •Введение
- •1. Внеаудиторная подготовка
- •1.1. Аминокислоты
- •1.1.1. Строение, классификация, номенклатура
- •1.1.2. Биологические функции аминокислот
- •1.1.3. Физико-химические свойства аминокислот
- •Физические свойства l-аминокислот
- •Кислотно-основные свойства протеиногенных аминокислот
- •1.1.4. Химические свойства аминокислот
- •1.1.4.1. Реакции с участием карбоксильной группы
- •1.1.4.2. Реакции с участием аминогруппы
- •1.1.4.3. Реакции с одновременным участием карбоксильной и аминогрупп
- •1.1.4.4. Специфические реакции аминокислот
- •Специфические реакции, используемые для идентификации и количественного анализа α-аминокислот и белков
- •1.2. Полипептиды
- •1.2.1. Природа пептидной связи
- •1.2.2. Классификация полипептидов, отдельные представили и их биологическая роль
- •1.2.2.1. Малые линейные пептиды
- •Пептидные гормоны
- •1.2.2.2. Циклопептиды
- •1.2.2.3. Белки
- •1.2.2.3.1. Уровни структурной организации белков
- •1.2.2.3.2. Классификация белков
- •1.2.2.3.3. Физико-химические свойства белков
- •1.2.2.3.4. Выделение белков
- •Контрольные вопросы, задачи и упражнения
- •2. Лабораторный практикум
- •2.1. Идентификация аминокислот и белков
- •2.1.1. Общие качественные реакции аминокислот
- •2.1.2. Специфические качественные реакции аминокислот
- •2.1.3. Хроматографические методы разделения и идентификации аминокислот и белков
- •Rf для аминокислот при разделении методом хроматографии на бумаге
- •Практическая контрольная работа по идентификации аминокислот и белков химическими и хроматографическими методами
- •2.2. Количественный анализ аминокислот и белков
- •2.2.1. Титриметрические методы анализа аминокислот
- •2.2.2. Спектральные методы количественного определения белка
- •Множители ƒ для вычисления концентрации белка
- •Практическая контрольная работа по количественному анализу аминокислот и белков
- •Библиографический список
- •Оглавление
- •Часть I 0
- •Аминокислоты и полипептиды
- •443100. Г. Самара, ул. Молодогвардейская, 244. Главный корпус
- •443100. Г. Самара, ул. Молодогвардейская, 244. Корпус №8
1.2. Полипептиды
1.2.1. Природа пептидной связи
«Я предложил название «полипептид» для продуктов, образуемых при соединении аминокислот связями амидного типа. Простейшим представителем этого класса соединений является гликоколь, так называемый глицилглицин, H2NCH2CO-NHCH2COOH. По количеству аминокислот, входящих в состав пептида, различают ди-, три-, тетрапептиды и т.д.».
Так Эмиль Фишер определил пептидную связь как амидную связь между аминокислотами (E. Fischer, Ber., Bd. 39, S. 530-610, 1906 г.).
Основная структурная особенность полипептидов – наличие цепей, составленных из аминокислотных остатков, связанных между собой α-амидными связями:
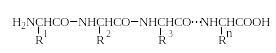
В биохимии эти связи принято называть пептидными.
Фундаментальная концепция, принятая еще в 60-х гг. прошлого века во всех работах, посвященных изучению конформации полипептидов, заключается в планарности транс– и цис-пептидной групп. Этот факт указывает на наличие n-π сопряжения между неподеленной парой электронов атома азота (n) и π-электронами карбонильной группы, что подтверждается также меньшей длиной связи между атомом азота и атомом углерода карбонильной группы (C−N = 1,32 Å) по сравнению с длиной связи между этим же атомом азота и α-углеродным атомом (N−Cα = 1,47 Å):

Вследствие n-π сопряжения вращение вокруг связи C–N затруднено. Поворот вокруг этой связи обозначается торсионным углом ω. Обычно угол ω равен 180° (транс-пептидная связь), однако изучение конформаций полипептидов показало что в некоторых случаях наблюдается искажение планарной формы отдельных пептидных звеньев (так называемая «пирамидальность») в пределах ±15°. Например, в кристаллической структуре гидрохлорида глицил-L-аланина отклонение от плоскости составляет +10,2º, а для глицил-L-лейцина -11,4º.
В отличие от этого вращение вокруг связей Сα−С и N−Cα осуществляется свободно и характеризуется двугранными торсионными углами ψ и φ соответственно, однако это не значит, что торсионные углы ψ и φ могут принимать какие угодно значения.
Для каждого конкретного сочетания определенных аминокислотных остатков ввиду стерических ограничений разрешены определенные комбинации торсионных углов φ и ψ.
Для углов φ и ψ остаются разрешенными сочетания, лежащие в пределах определенных дискретных областей. Информацию о связи между торсионными углами φ и ψ в каждом пептидном звене представляют графически с помощью конформационной φ/ψ-карты (карты Рамачандрана).
На рис.1.6 представлена карта, отражающая возможные энергетически выгодные, энергетически невыгодные, но возможные, и запрещенные сочетания торсионных углов φ и ψ.
Как видно из рис. 1.6, в полипептидах реализуются весьма ограниченные соотношения торсионных углов φ и ψ. Определенные возможные сочетания углов, как правило, соответствуют определенным упорядоченным конформациям участков полипептидной цепи (подробнее о структурной организации полипептидов см. п. 1.2.2.3.1). На рис. 1.6 цифрами отмечены области углов φ и ψ, характерные для разных типов вторичной структуры белков.

Р и с.1.6. Конформационная φ/ψ – карта полипептидной цепи
