
- •Определение коэффициента поверхностного натяжения
- •Теоретическая часть Особенности строения жидкостей
- •Поверхностно-активные вещества
- •Зависимость коэффициента поверхностного натяжения от температуры
- •Влияние второй среды
- •Практическая часть Идея метода
- •Торсионный динамометр;
- •Термометр;
- •Контрольные вопросы
- •Список литературы
Поверхностно-активные вещества
Уменьшение поверхностной энергии US может происходить не только при сокращении площади поверхности S, но и при изменении физических свойств поверхности, приводящем к изменению α. Поэтому при добавлении в жидкость другой жидкости с меньшим поверхностным натяжением последняя будет адсорбироваться преимущественно в поверхностном слое, в результате чего поверхностное натяжение уменьшается. Это обусловлено тем, что силы взаимодействия этих молекул с молекулами растворителя меньше сил взаимодействия между молекулами растворителя. Молекулы таких веществ, прежде всего, поступают в поверхностный слой и лишь после того, как он окажется заполненным ими достаточно плотно, проникают в основной объем жидкости. При выходе таких молекул на поверхность совершается меньшая работа, поэтому их скопление на поверхности уменьшает удельную поверхностную энергию, т. е. коэффициент α. Такое вещество называется поверхностно-активным (ПАВ), а явление повышенной концентрации молекул этих веществ в поверхностном слое растворителя называют адсорбцией. Поверхностно активными веществами по отношению к воде являются многие органические вещества: жирные кислоты, их соли, спирты, эфиры и другие.
Другие вещества увеличивают поверхностное натяжение (например, раствор сахара, растворы различных солей и т. д.). Такое вещество, наоборот, концентрируется вне поверхностного слоя жидкости. При его добавлении в раствор, содержащий поверхностно-активные вещества, последние интенсивно выталкиваются на поверхность. Например, добавление соли в мыльный раствор вызывает вытеснение мыла на поверхность раствора. Такое явление носит название отрицательной адсорбции.
Изменение коэффициента поверхностного натяжения раствора при введении ПАВ определяют с помощью эмпирического уравнения Шишковского:
![]() , (1)
, (1)
где 0 – поверхностное натяжение растворителя (Н/м), - поверхностное натяжение раствора, А и В – эмпирические константы, причем величина А мало меняется от вещества к веществу, а В зависит от поверхностной активности вещества, c- концентрация раствора (кмоль/м3).
Уравнение (10) является очень точным и применимо практически для всех ПАВ в широкой области концентраций растворов. Если концентрация ПАВ достаточно велика, то произведение Вc >> 1, следовательно, единицей в уравнении Шишковского можно пренебречь. Тогда выражение (8) примет вид
![]() (2)
(2)
или
![]() . (3)
. (3)
Обозначим постоянные при изотермических условиях величины как К:
![]() .
.
Тогда
![]() . (4)
. (4)
Следовательно, при относительно высокой концентрации растворов ПАВ их поверхностное натяжение должно уменьшаться экспоненциально с увеличением концентрации.
Зависимость коэффициента поверхностного натяжения от температуры
С повышением температуры коэффициент поверхностного натяжения должен уменьшаться. Это следует из того, что при критической температуре он должен быть равен нулю, так как при этой температуре исчезает разница между жидкостью и её паром, а значит, исчезает и поверхность, разделяющая обе фазы. Точный вид зависимости коэффициента поверхностного натяжения от температуры не может быть установлен теоретически. Приближённо зависимость коэффициента поверхностного натяжения от температуры выражается соотношением, вид которого был установлен венгерским физиком Роландом Этвёшем:
 (5)
(5)
Это соотношение называют уравнением Этвёша. В этой формуле В – постоянный коэффициент, Тк – критическая температура, – плотность жидкости, М – молярная масса жидкости, – небольшая величина, имеющая размерность температуры, В – постоянный коэффициент. Коэффициент B практически одинаков для всех жидкостей и равен 2,1.10-7 Дж/К.
Критической температурой называют температуру, при которой стирается различие между жидким и газообразным состоянием вещества. В критическом состоянии коэффициент поверхностного натяжения жидкости обращается в ноль. Каждое вещество имеет свою критическую температуру. Формула (1) неприменима вблизи самой критической точки, при Т = Тк должно быть α = 0, что противоречит этой формуле.
Из соотношения (5) следует, что температурная зависимость коэффициента натяжения, выражается равенством:
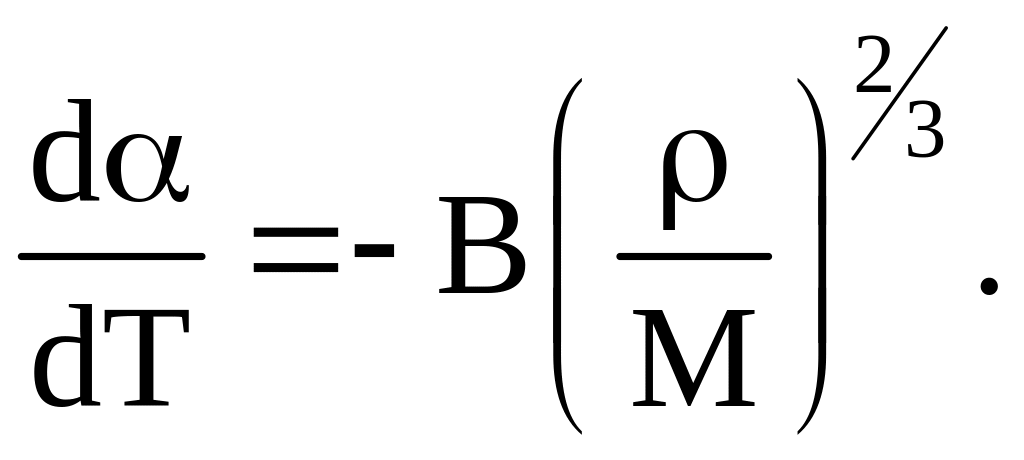 (6)
(6)
Из (6) видно, что зависимость коэффициента поверхностного натяжения от температуры тем сильнее, чем больше плотность жидкости и чем меньше её молярная масса.
Несмотря на приближённый характер уравнений, они настолько хорошо оправдываются на опыте, что ими пользуются для определения молекулярного веса жидкостей.
