
- •1. Поняття хімічної термодинаміки
- •2. Термодинамічні системи
- •3. Інтенсивні та екстенсивні параметри системи
- •4. Повна енергія системи. Внутрішня енергія системи
- •5. Перший закон термодинаміки
- •6. Ентальпія системи
- •Тому зручно ввести функцію:
- •7. Теплові ефекти
- •8. Закон Гесса
- •9. Ентропія системи
- •10. Мікро- і макростан системи. Рівняння Больцмана
- •11. Стандартні ентропії
- •Так, зміна ентропії в реакції
- •12. Критерій самовільного перебігу реакцій
- •13. Поняття про біохімічну термодинаміку
- •14. Лабораторна робота
- •15. Контрольні запитання
8. Закон Гесса
У всіх хімічних явищах виконується закон збереження енергії. Відпо-відно і усі закони термохімії є наслідком першого закону термодинаміки.
У 1840 р. Г.І. Гесс встановив основний закон термохімії: тепловий ефект хімічної реакції залежить тільки від початкового і кінцевого стану реагуючих речовин і не залежить від шляху перебігу реакції.
Цей закон також є окремим випадком першого начала термодинаміки стосовно хімічних реакцій, які проходять в ізохорних або ізобарних умовах.
Так, карбон(IV) oксид можна отримати безпосередньо, спалюючи вуг-лець у кисні, або ж спочатку спалюють його до карбон(II) оксиду, а потім вже до карбон(IV) оксиду.
Ці два шляхи можна зобразити у вигляді такої схеми:
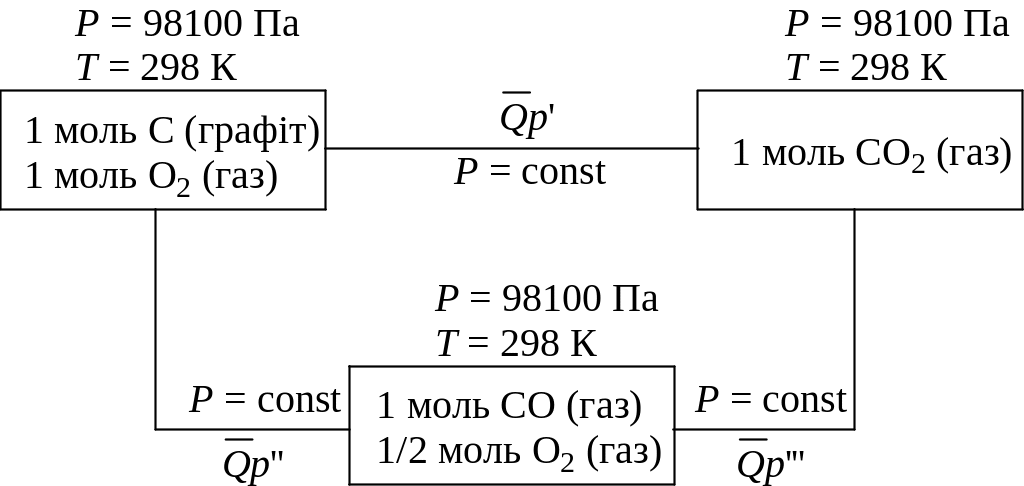
В обох випадках початкові стани системи С і О2 та кінцеві стани СО2 однакові. Сумарні теплові ефекти дорівнюють для першого шляху реакції:
С + О2 СО2 + 409,2 кДж; (39)
 сума
409,2 кДж
сума
409,2 кДж
для другого шляху реакції:
С
+
![]() О2
СО + 124,3 кДж (40)
О2
СО + 124,3 кДж (40)
СО + О2 СО2 + 284,9 кДж
сума 409,2 кДж
Як бачимо, тепловий ефект першого процесу дорівнює сумарному тепловому ефекту другого процесу.
Закон Гесса має велике практичне застосування. Він дає можливість розраховувати теплові ефекти, не проводячи хімічні реакції. Цей закон виконується також у фізіології і біохімії. Так, кількість теплоти, яка отриму-ється від окиснення харчових продуктів в організмі в результаті цілої серії складних реакцій, і кількість теплоти, яка виділяється при спалюванні цих речовин у калориметричній бомбі, виявились тотожними (табл. 7).
Таблиця 7. Теплота згоряння 1 г харчових речовин
в організмі тварин і калориметрі
Речовина |
Теплота згоряння, кДж |
|
|
в організмі |
в калориметрі |
Вуглеводи |
17,15 |
17,15 |
Жири |
38,91 |
38,91 |
Білки |
17,15 |
23,85 |
У табл. 7 подано середні дані, тому що різні вуглеводи, білки, жири мають свої індивідуальні особливості, не повністю окиснюються в орга-нізмі і т.ін. Як продукт неповного окиснення білків із організму виділя-ється сечовина. Цим пояснюється, що при повному спалюванні білка в калориметричній бомбі теплоти виділяється більше, ніж при окисненні його у живому організмі.
У термохімічних розрахунках часто користуються наслідками, які безпосередньо витікають із закону Гесса.
Наслідок 1. (Закон Лавуазьє-Лапласа): кількість теплоти, яка не-обхідна для розкладу складної речовини на більш прості, дорівнює кіль-кості теплоти, яка виділяється при його утворенні із простих речовин.
Так, теплота утворення одного моля кальцій оксиду із кальцію і кисню 634,71 кДж, тобто:
Са + О2 СаО + 634,71 кДж.
Відповідно для розкладу одного моля СаО на кальцій і кисень необ-хідно витратити 634,71 кДж, тобто:
СаО Са + О2 - 634,71 кДж.
Закон Лавуазьє-Лапласа є окремим випадком закону збереження енер-гії. Він виконується при утворенні хімічних сполук із більш складних речовин. Наприклад, теплота утворення Li2СО3 із Li2O і CO2 дорівнює 226,77 кДж. Для розкладу 1 моля Li2СО3 на вихідні оксиди Li2O і CO2 необхідно витратити також 226,77 кДж енергії.
Наслідок 2: Якщо здійснюються дві реакції, які призводять із різних початкових станів до однакових кінцевих, то різниця між їх тепло-вими ефектами є тепловим ефектом переходу із одного початкового стану в інший.
Цей наслідок також використовується в термохімічних розрахунках. Наприклад, теплові ефекти при спалюванні вугілля високого ступеня чистоти, алмазу і графіту до карбон(IV) оксиду такі:
Свуг. + О2 СО2 + 409,20 кДж;
Сгр. + О2 СО2 + 393,51 кДж;
Салм. + О2 СО2 + 395,39 кДж.
Використовуючи наслідок із закону Гесса, можна розрахувати теплові ефекти переходу із одного алотропного стану в інший. Так, при переході від вугілля до графіту виділяється 409,20 - 393,51 = 15,69 кДж/моль; при переході від графіту до алмазу поглинається 393,51 - 395,39 = = -1,88 кДж/моль.
Наслідок 3. Якщо здійснюються дві реакції, які призводять від однакових початкових станів до різних кінцевих, то різниця між їх тепловими ефектами є тепловим ефектом переходу із одного кінцевого стану в інший.
Цей наслідок дає можливість визначити теплові ефекти таких реакцій, які або не реалізуються, або не можуть бути проведені чисто і до кінця.
Наприклад, утворення 1 моля води внаслідок горіння водню в залеж-ності від її кінцевого фізичного стану супроводжується наступними ефек-тами:
H2
+
![]() O2
H2O(г)
+241,83 кДж;
O2
H2O(г)
+241,83 кДж;
H2 + O2 H2O(р) +285,84 кДж;
H2 + O2 H2O(т) +291,67 кДж.
Звідки
H2O(т) H2O(р) –5,83 кДж;
H2O(р) H2O(г) –44,01 кДж;
H2O(т) H2O(г) –49,84 кДж.
Наслідок 4. Тепловий ефект реакції дорівнює різниці між сумою теплот згоряння вихідних речовин і сумою теплот згоряння кінцевих продуктів з урахуванням коефіцієнтів речовин у рівнянні реакції.
Для багатьох сполук не вдається здійснити реакцію їх утворення із простих речовин і тим більш виміряти теплоту утворення. Однак у більшості випадків можна здійснити реакцію повного згоряння. Тому термохімічні розрахунки дуже часто здійснюють з використанням теплот згоряння вихідних речовин і продуктів реакції. Теплотою згоряння називається тепловий ефект реакції повного згоряння 1 моля даної сполуки до утворення вищих оксидів.
Закон Гесса розповсюджується не лише на хімічні реакції, але й на усі процеси, які супроводжуються тепловими ефектами, – фазові перетворен-ня, розчинення, кристалізацію, випаровування і т.ін.
Наслідок із закону Гесса можна сформулювати так:
Зміна ентальпії реакції дорівнює різниці між сумою теплот ут-ворення (Нутв.) продуктів реакції і сумою теплот утворення вихідних речовин.
При алгебраїчному підсумовуванні враховуються стехіометричні коефіцієнти.
Так, для реакції типу
mA + nB pC + qD
DН = (рDНутв.С + qDНутв.D) - (mDНутв.А + nDHутв.В). (41)
Теплотою утворення (ентальпією) називається тепловий ефект реакції утворення одного моля речовини із простих речовин, стійких за стандартних умов (Р = 101,3 кПа, Т = 298 К).
Стандартні
теплоти утворення відомі приблизно для
восьми тисяч речовин. Вони позначаються
![]() ,
де один із нижніх індексів вказує теплоту
утворення (утв.), інший – округлене
значення температури 25С
за абсолютною шкалою, тобто 298
К). Часто
один або два індекси вилучаються.
,
де один із нижніх індексів вказує теплоту
утворення (утв.), інший – округлене
значення температури 25С
за абсолютною шкалою, тобто 298
К). Часто
один або два індекси вилучаються.
Стандартні теплоти (ентальпії) утворення деяких речовин наведені в табл. 8.
Таблиця 8. Стандартні термодинамічні функції деяких речовин
Речовина |
|
|
|
Al2O3 (к) |
-1676,0 |
50,9 |
-1582,0 |
C (графіт) |
0 |
5,7 |
0 |
CH4 (г) |
-74,9 |
186,2 |
-50,8 |
C2H2 (г) |
226,8 |
200,8 |
209,2 |
C2H4 (г) |
52,3 |
219,4 |
68,1 |
C6H6 (р) |
82,9 |
269,2 |
129,7 |
C2H5OH (р) |
-277,6 |
160,7 |
-174,8 |
CO (г) |
-110,5 |
197,5 |
-137,1 |
CO2 (г) |
-393,5 |
213,7 |
-394,4 |
Cl2 (г) |
0 |
222,9 |
0 |
H2 (г) |
0 |
130,5 |
0 |
HCl (г) |
-92,3 |
186,8 |
-95,2 |
HF (г) |
-270,7 |
178,7 |
-272,8 |
HJ (г) |
26,6 |
206,5 |
-1,8 |
H2O (г) |
-241,8 |
188,7 |
-228,6 |
Н2О (р) |
-285,8 |
70,1 |
-237,3 |
H2S (г) |
-21,0 |
205,7 |
-33,8 |
N2 (г) |
0 |
200,0 |
0 |
NH3 (г) |
-46,2 |
192,6 |
-16,7 |
NO2 (г) |
33,5 |
240,2 |
51,5 |
N2O4 (г) |
9,6 |
303,8 |
98,4 |
O2 (г) |
0 |
205,0 |
0 |
S(к., ромб.) |
0 |
0 |
31,9 |
SO2 (г) |
-296,9 |
248,1 |
-300,2 |
SO3 (г) |
-395,8 |
256,7 |
-371,2 |
,
![]() ,
,
![]() – стандартні
ентальпія,
ентропія
і
енергія
Гіббса
утворення
деяких
речовин;
к
– кристалічний
стан,
г
– газоподібний,
р
– рідинний.
– стандартні
ентальпія,
ентропія
і
енергія
Гіббса
утворення
деяких
речовин;
к
– кристалічний
стан,
г
– газоподібний,
р
– рідинний.
Теплоти утворення простих речовин, стійких за стандартних умов, приймаються рівними нулю.
За допомогою табл. 8 і рівняння (41) можна розрахувати тепловий ефект будь-якої реакції. Наприклад, для реакції взаємодії сульфур(ІV) оксиду з гідроген сульфідом:
SO2 (г) + 2H2S (г) 3S (ромб.) + 2H2O (р)
Відповідно до наслідку із закону Гесса запишемо:
![]() =
(3
=
(3![]() + 2
+ 2![]() )
– (
)
– (![]() +
2
+
2![]() )
)
і, підставивши табличні дані, отримуємо:
= (3 0 + 2 (-285,84)) - (-296,9 + 2 (-20,15)) = -234,48 кДж.
Термохімічними розрахунками можна визначати енергію хімічних зв’язків, кристалічних ґраток, теплові ефекти фазових перетворень, теплоти розчинення і гідратації і т.ін.
Теплоти утворення неорганічних речовин пов’язані зі знаходженням у періодичній системі елементів Д.І. Менделєєва.
Хімічні реакції проходять як зі зменшенням Н (це екзотермічні реакції, у них DН 0), так і зі збільшенням Н (це ендотермічні реакції, у них DН 0).
