- •1. Поняття хімічної термодинаміки
- •2. Термодинамічні системи
- •3. Інтенсивні та екстенсивні параметри системи
- •4. Повна енергія системи. Внутрішня енергія системи
- •5. Перший закон термодинаміки
- •6. Ентальпія системи
- •Тому зручно ввести функцію:
- •7. Теплові ефекти
- •8. Закон Гесса
- •9. Ентропія системи
- •10. Мікро- і макростан системи. Рівняння Больцмана
- •11. Стандартні ентропії
- •Так, зміна ентропії в реакції
- •12. Критерій самовільного перебігу реакцій
- •13. Поняття про біохімічну термодинаміку
- •14. Лабораторна робота
- •15. Контрольні запитання
12. Критерій самовільного перебігу реакцій
Із рівняння (50) виходить, що в залежності від співвідношення між DH і TDS визначається знак зміни енергії Гіббса і можна встановити напрямок хімічних реакцій.
Реакція самовільно протікає в прямому напрямку, якщо DG 0 при P = const і T = const.
Очевидно (рівняння 50), що чим більший ріст ентропії і більше змен-шення ентальпії, тим більше зменшення енергії Гіббса і тим повніше протікає реакція в прямому напрямку.
Для розрахунку G хімічної реакції використовують рівняння, анало-гічне для розрахунку DH з урахуванням стехіометричних коефіцієнтів:
Gх.р. = (Gутв.)кін. - (Gутв.)вих. , (51)
де
Gутв.
– зміна
енергії Гіббса при утворенні сполук із
простих речовин. Звичайно,
розрахунки здійснюють при стандартних
умовах (P
= 101,3 кПа і Т
= 298К), що дозволяє отримувати значення
G,
які
можна порівнювати.
Їх прийнято позначати
![]() .
Для більшості
речовин
відомі і зведені у таблицю (табл. 8). Якщо
G
0 при
P
= const і
T
= const, тоді
реакція в прямому напрямку самовільно
не протікає, тому що супроводжується
збільшенням ентальпійного і зниженням
ентропійного факторів. Щоб такий процес
протікав, необхідне надходження енергії
ззовні.
.
Для більшості
речовин
відомі і зведені у таблицю (табл. 8). Якщо
G
0 при
P
= const і
T
= const, тоді
реакція в прямому напрямку самовільно
не протікає, тому що супроводжується
збільшенням ентальпійного і зниженням
ентропійного факторів. Щоб такий процес
протікав, необхідне надходження енергії
ззовні.
При рівності ентальпійного і ентропійного факторів G = 0 і система (реакція) перебуває в стані рівноваги, тобто, G = 0 при P = const і Т = const.
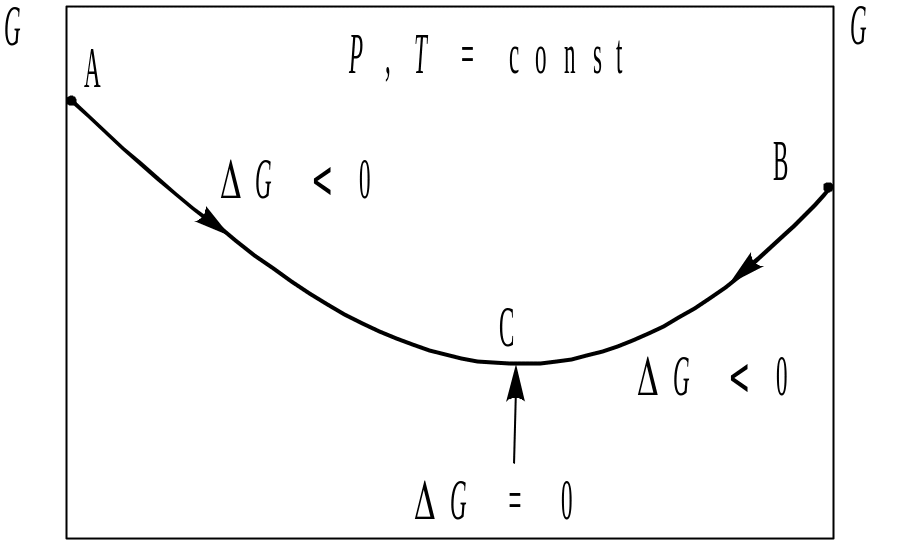
Будь-який оборотний хімічний процес протікає самовільно у тому напрямку, який наближає систему до рівноваги (рис. 26). Нехай для хімічної оборотної реакції енергія Гіббса G вихідних речовин відповідає точці А. У ході реакції G буде зменшуватися (G 0) і при досягненні рівноваги (точка С) буде мати мінімальні значення. При зворотному напрямку реакції G буде зменшуватися по кривій ВС до точки С (G = 0). Як бачимо, положення точки С (при G = 0) не залежить від того, з якого боку починається процес.
Здатність речовин до хімічної взаємодії інакше називають хіміч-ною спорідненістю. Мірою хі-мічної спорідненості слугує зміна вільної енергії Гіббса в кожній ре-акції. Очевидно, чим більш не-гативна величина G, тим речо-вина більш реакційно здатна. Із рівняння (50) виходить, що |
Рис. 26. Залежність енергії Гіббса від складу хімічної системи |
здатність речовини до хімічної взаємодії визначається конкуруючим впли-вом ентальпійного і ентропійного факторів. Тут можливі три крайніх ви-падки.
1. Т = 0, S = 0 і (-TS) = 0, тоді G = Н. У цьому випадку хімічна спо-рідненість спостерігається при невисоких температурах, коли Н TDS.
2. Н = 0, тоді G = (-TS), у цьому випадку хімічна спорідненість визначається ентропійними змінами.
3. G =0, Н = TS, що відповідає хімічній рівновазі, яка особливо характерна для фазових переходів.
Одначе для переважної більшості процесів ентальпійний і ентропійний фактори не дорівнюють нулю, тобто Н 0 і (ТS) 0. У випадках, коли Н 0 і ТS 0, здатність речовини до хімічної взаємодії максимальна. При Н 0 і ТS 0 самовільно процес не протікає. Це й зрозуміло: у першому випадку хімічна спорідненість посилюється обома факторами, в другому – обидва фактори його зменшують.
Величина DG хімічної реакції відображає сукупність змін, які виникають з реагуючими речовинами і пов’язані з послабленням, розривом, утворенням і посиленням хімічних зв’язків між частками.