- •Природа хімічного зв’язку
- •1. Метод валентних зв’язків
- •2. Поняття про валентність
- •3. Властивості ковалентного зв’язку
- •4. Гібридизація атомних орбіталей і геометрична форма молекули
- •5. Делокалізовані p-зв’язки
- •6. Полярні і неполярні ковалентні зв’язки
- •7. Зарядність атомів
- •8. Окисне число
- •9. Донорно-акцепторний зв’язок
- •10. Водневий зв’язок
- •11. Іонний зв’язок
- •Сума зарядів
- •12. Зв’язок між будовою молекул та їх фізіологічною дією
- •13. Контрольні запитання
1. Метод валентних зв’язків
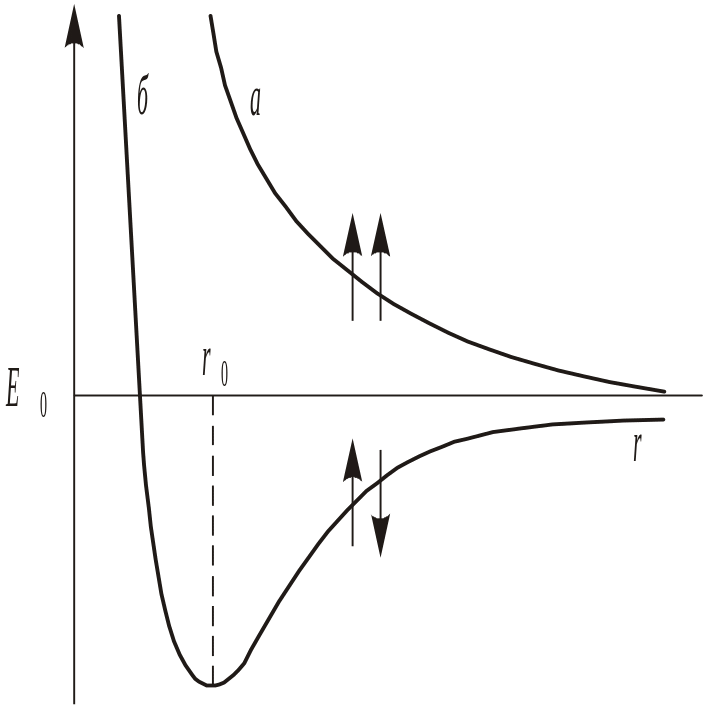
Ми вже знаємо, що стійка молекула може утворюватися лише при умові зменшення потенціальної енергії системи атомів, що взаємодіють. Квантово-механічний опис будови молекул отримують, як і у випадку ба-гатоелектронних атомів, тільки на основі наближених рішень рівняння Шредінгера. Вперше подібний наближений розрахунок був зроблений у 1927 р. В. Гейтлером і Ф. Лондоном для молекули Гідрогену. В результаті вони отримали рівняння, яке дає можливість знайти залежність потен-ціальної енергії E системи, що складається з двох атомів Гідрогену, від відстані між ядрами цих атомів. При цьому виявилося, що результати роз-рахунку залежать від того, однакові чи протилежні за знаками спіни елек-тронів, що взаємодіють. При співпаданні напрямку спінів (рис. 12, крива а) зближення атомів призводить до безперервного зростання енергії системи. У цьому випадку для зближення атомів потрібна затрата енергії, тому такий процес виявляється енергетично невигідним і хімічний зв’язок між атомами не виникає. У разі протилежно напрямлених спінів (рис. 12, крива б) зближення атомів до деякої відстані rо супроводжується зменшенням енергії системи. При r = rо система має найменшу потенціальну енергію – знаходиться в найбільш стійкому стані; подальше зближення атомів знову призводить до збільшення енергії. Але це і означає, що у випадку протилежно напрямлених спінів атомних електро-нів утворюється молекула H2 – стійка система з двох атомів Гідрогену, які знаходяться на певній відстані один від другого.
Утворення хімічного зв’язку між атомами Гідрогену є результатом взаємопроникнення (“перекривання”) електронних хмар, яке виникає при зближенні атомів, що взаємодіють (рис. 13).
|
|
|
|
Рис. 12. Енергія системи, що складається з двох атомів Гідрогену: а – при однаково на-прямлених спінах електронів; б – при проти-лежно напрямлених спінах; Ео – енергія сис-теми з двох атомів Гідрогену, які не взаємо-діють; rо – між’ядерна відстань у молекулі Гідрогену |
Рис. 13. Схема перекри-вання атомних елект-ронних хмар у молекулі Гідрогену
|
У результаті такого взаємопроникнення густина негативного електрон-ного заряду в між’ядерному просторі зростає. Позитивно заряджені ядра атомів притягуються до ділянки перекривання електронних хмар. Це при-тягування переважає над взаємним відштовхуванням однойменно заряд-жених електронів, так що в результаті утворюється стійка молекула.
Дослідження Гейтлера і Лондона дало можливість зробити висновок, що хімічний зв’язок у молекулі Гідрогену здійснюється шляхом утворення пари електронів із протилежно напрямленими спінами, які належать двом атомам. Процес “парування” електронів при утворенні молекули Гідрогену може бути відтворений за схемою:
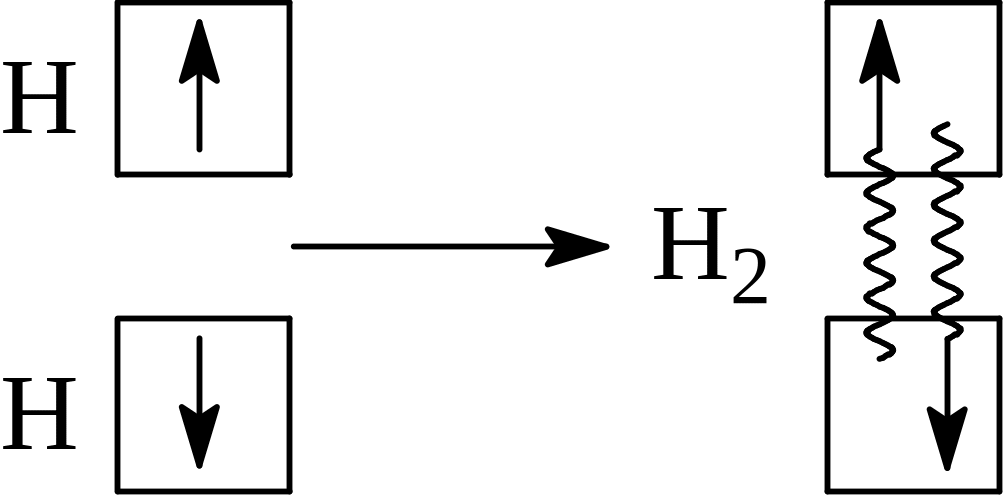
Хвилясті лінії на схемі показують, що в молекулі Гідрогену кожен електрон має місце в квантових комірках обох атомів, тобто рухається в силовому полі, утвореному двома силовими центрами-ядрами атомів Гід-рогену. Такий двоелектронний двоцентровий зв’язок називається кова-лентним зв’язком.
Уявлення про механізм утворення хімічного зв’язку, розвинуте Гейтле-ром і Лондоном на прикладі молекули Гідрогену, були розповсюджені і на більш складні молекули, розроблена на тій основі теорія хімічного зв’язку отримала назву методу валентних зв’язків (МВЗ). Цей метод дав теоре-тичне пояснення найважливішим властивостям ковалентного зв’язку, дав можливість зрозуміти будову великої кількості молекул. Хоча, як ми поба-чимо далі, цей метод не виявився універсальним і в ряді випадків не в змозі правильно зобразити структуру і властивості молекул, але він віді-грав велику роль у розробці квантово-механічної теорії хімічного зв’язку і не втратив свого значення донині.
В основі методу МВЗ лежать такі положення.
1. Ковалентний хімічний зв’язок утворюється двома електронами з протилежними спінами, причому ця електронна пара належить обом ато-мам. Комбінація таких двоелектронних двоцентрових зв’язків, що відо-бражають електронну структуру молекули, отримала назву валентних схем.
2. Ковалентний зв’язок тим міцніший, чим більшою мірою перекри-ваються електронні хмари, які взаємодіють.
Для наочного зображення валентних схем користуються таким чином: електрони, що знаходяться на зовнішньому енергетичному рівні позна-чаються крапками, які розміщуються навколо хімічного символу атома. За-гальні для двох атомів електрони позначають крапками, які розміщуються між їх хімічними символами; подвійний чи потрійний зв’язок позначають відповідно двома чи трьома парами загальних крапок. Застосовуючи ці позначення, утворення молекули Гідрогену можна зобразити таким чином:
![]() .
.
Ця схема показує, що при об’єднанні двох атомів Гідрогену в молекулу кожний з атомів одержить стійку двоелектронну оболонку, подібну до електронної оболонки атома Гелію. Аналогічними схемами можна пред-ставити утворення молекули Нітрогену:
![]() .
.
При з’єднанні двох атомів Нітрогену в молекулу, загальними стають три пари електронів (потрійний зв’язок), завдяки чому зовнішня оболонка кожного атома доповнюється до стійкої восьмиелектронної конфігурації атома Неону.
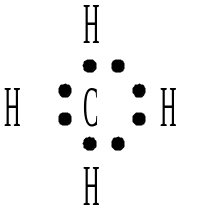
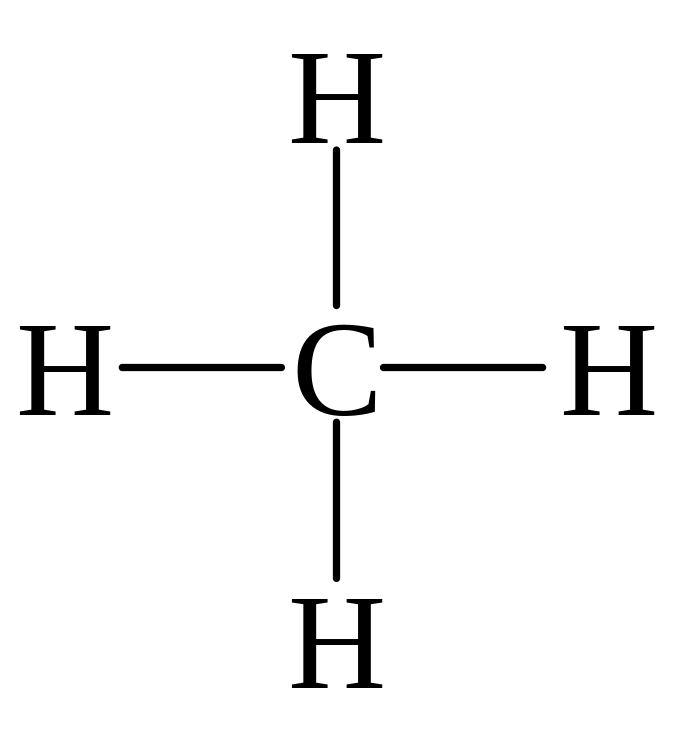
Будова молекул деяких складних речовин (амоніаку, води, карбон(IV) оксиду і метану) можна зобразити схемами:
|
|
|
|
амоніак |
вода |
карбон(IV) оксид |
метан |
У молекулі амоніаку кожний з трьох атомів Гідрогену пов’язаний з атомом Нітрогену парою загальних електронів (один електрон від атома Гідрогену, другий – від атома Нітрогену). Таким чином, Нітроген має восьмиелектронну зовнішню оболонку, а ядро кожного атома Гідрогену оточене двома електронами, утворюючи стійку “гелієву” оболонку. Такі ж оболонки мають атоми Гідрогену в молекулі води і метану. В молекулі карбон(IV) оксиду, де атом Карбону пов’язаний з кожним з атомів Ок-сигену двома парами електронів (подвійний зв’язок), всі три атоми мають восьмиелектронні зовнішні оболонки. З наведених схем видно, що кожна пара електронів, що пов’язує два атоми, відповідає одній рисочці, яка відображає валентний зв’язок у структурних формулах:
|
|
|
|
амоніак |
вода |
карбон(IV) оксид |
метан |
Кількість таких загальних електронних пар, що пов’язують атом даного елемента з іншими атомами, або, іншими словами, число утворених атомом ковалентних зв’язків, називається ковалентністю елемента у від-повідній сполуці. Так, ковалентність Нітрогену в молекулах N2 і NH3 до-рівнює трьом, ковалентність Оксигену в молекулах CH4 і CО2 – чотирьом.