
- •Природа хімічного зв’язку
- •1. Метод валентних зв’язків
- •2. Поняття про валентність
- •3. Властивості ковалентного зв’язку
- •4. Гібридизація атомних орбіталей і геометрична форма молекули
- •5. Делокалізовані p-зв’язки
- •6. Полярні і неполярні ковалентні зв’язки
- •7. Зарядність атомів
- •8. Окисне число
- •9. Донорно-акцепторний зв’язок
- •10. Водневий зв’язок
- •11. Іонний зв’язок
- •Сума зарядів
- •12. Зв’язок між будовою молекул та їх фізіологічною дією
- •13. Контрольні запитання
10. Водневий зв’язок
Утворення зв’язку такого типу було вперше запропоновано в 1912 р. Муром і Уінміллом для пояснення того факту, що амоніак, метиламін, ди-метиламін є слабкими основами, тоді як тетраметиламоній гідроксид є такою сильною основою, як і КОН. Ці автори запропонували, що амоніак або будь-які його похідні можуть утворювати з водою зв’язок особливого типу – “водневий зв’язок” – і утворений комплекс може частково дисо-ціювати на катіони і гідроксид-іони:
R3N + H2O R3N ... H ... OH R3NH+ + OH .
З іншого боку, завдяки тому, що у іона R4N+ немає атомів Гідрогену, пов’язаних з Нітрогеном, він не може об’єднуватись таким шляхом з гід-роксид-іонами, і тому тетраметиламоній гідроксид дисоційований у вод-ному розчині цілком, так як КОН.
З того часу було отримано багато даних, які показували, що в інших випадках атом Гідрогену може об’єднувати два інших атоми, в більшості випадків атоми Нітрогену, Оксигену чи Флуору. Чітким свідченням наяв-ності водневого зв’язку є аномально високі температури кипіння гідридів цих елементів. Температура кипіння тим вища, чим більші сили, які діють між молекулами даної речовини. Взагалі міжмолекулярна взаємодія (при інших рівних умовах) тим сильніша, чим більша молекулярна маса. Тому слід чекати, що в ряду типу Н2О, Н2Se і Н2Те температури кипіння повинні монотонно збільшуватись. Такий хід спостерігається у гідридів елементів IVВ групи, але у гідридів елементів груп VB, VIB і VIIB перший член ряду сильно відхиляється від прямої. Це пояснюється тим, що утворення вод-невих зв’язків призводить до виникнення більших молекул, ніж просто Н2О (рис. 23) і т.ін., між якими діють більші сили, тому їх температури ки-піння вищі. Така асоціація у рідкому стані характеризує й інші аномальні властивості цих рідин, так, наприклад, той факт, що вода має дуже високу діелектричну проникність і максимум густини при 4°.
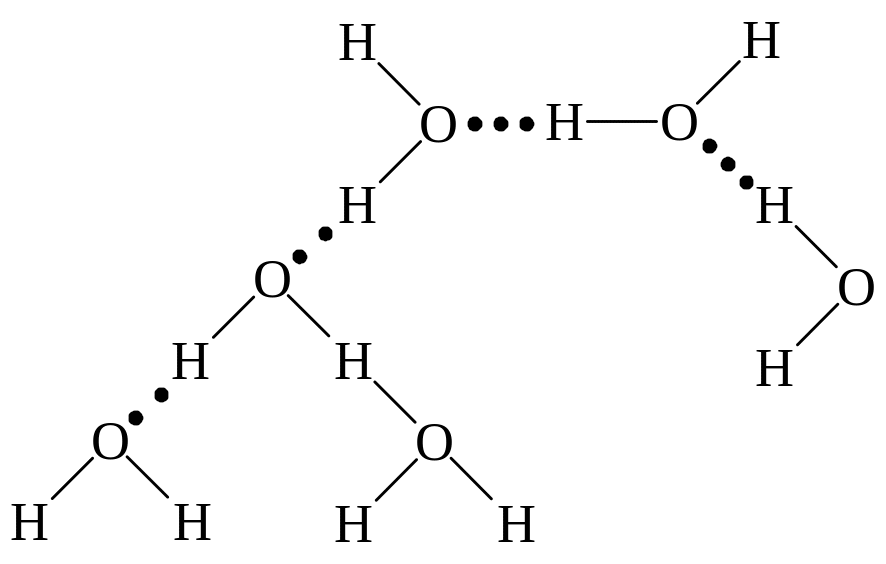
Рис. 23. Водневий зв’язок у воді
Вимірювання густини парів показує, що більшість карбонових кислот також асоційовані в подвійні молекули як в парах, так і в неводних розчи-нах. Дослідження дифракції електронів показало, що в димері форміатної кислоти дві молекули зв’язані одна з одною водневими зв’язками таким чином:
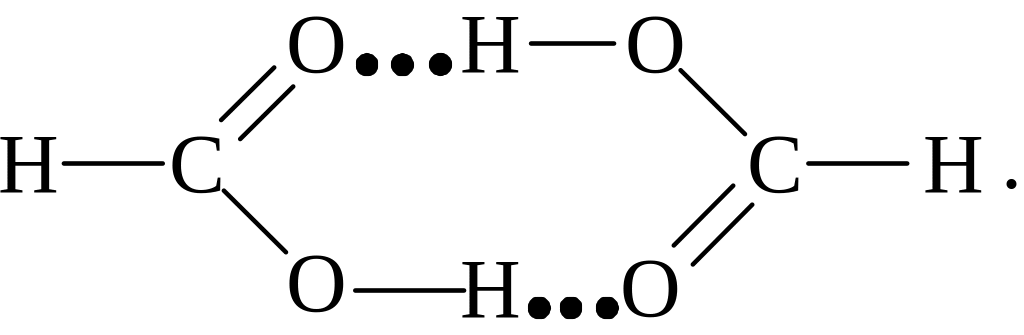
Аналогічно побудовані й інші димеризовані кислоти.
Утворення водневих зв’язків дає можливість пояснити також і відмін-ності у фізичних властивостях деяких ізомерів. Так, наприклад, м-нітро-фенол (97°) і n-нітрофенол (114°) мають більш високі температури плав-лення, ніж о-нітрофенол (45°). Вважається, що в мета- і пара-сполуках має місце міжмолекулярний водневий зв’язок, тоді як в орто-ізомері його ут-воренню запобігає внутрішньомолекулярний водневий зв’язок, якому сприяють стеричні умови (рис. 24).
Тому міжмолекулярна взаємодія в орто-сполуці сильно послаблена порівняно з іншими ізомерами, а його температура плавлення відповідно знижена. Виявити такий тип внутрішньомолекулярного водневого зв’язку можна за допомогою спектроскопічних досліджень. Водневий зв’язок є також важливим фактором у багатьох структурах кристалів, які містять атоми Гідрогену.
Енергія водневого зв’язку складає близько 5 ккал/моль і лише в деяких випадках досягає 50 ккал/моль.
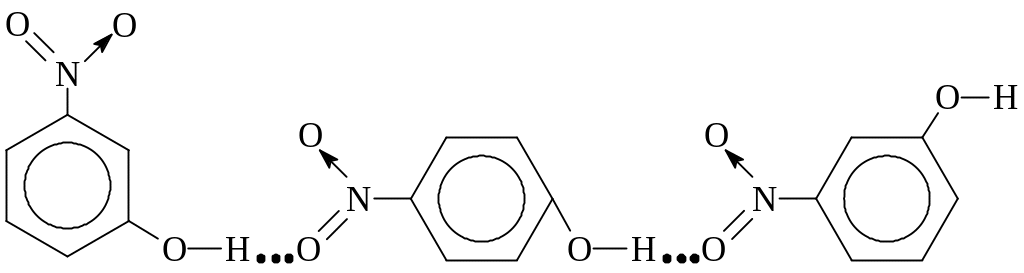
м-нітрофенол n-нітрофенол і т.п.
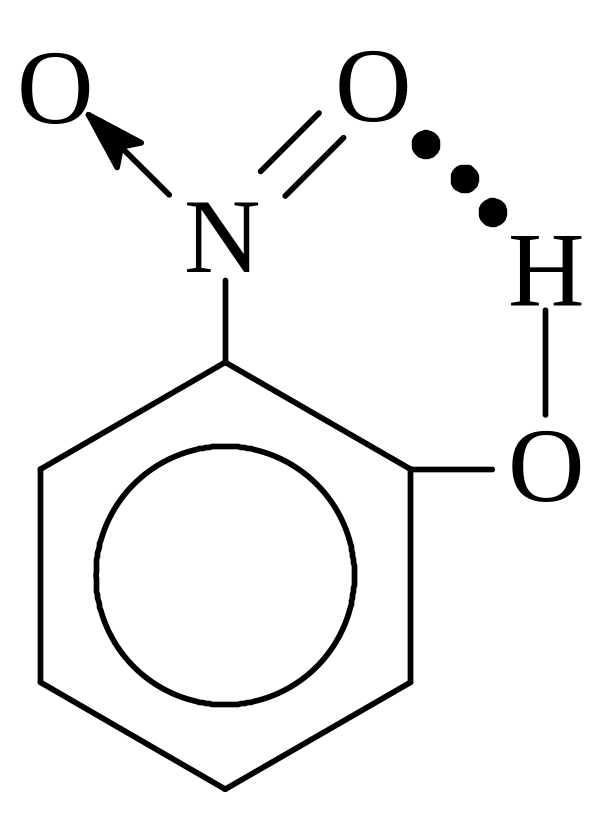
Рис. 24. Водневі зв’язки в нітрофенолах
Утворення водневих зв’язків у високомолекулярних сполуках, які вхо-дять до складу живих організмів (білки, жироподібні речовини, ферменти і т.ін.), а також у речовинах типу целюлози, штучних волокон і пластмас призводить до значного ускладнення міжатомних зв’язків і формування трихатомних структур. Так, наприклад, у поліпептидному ланцюгу білків іміногрупа кожного третього (уздовж ланцюга) амінокислотного залишку пов’язана з карбонільною групою водневим зв’язком, причому увесь полі-пептидний ланцюг набуває форми спіралі. Внутрішньомолекулярні вод-неві зв’язки визначають також структуру ДНК та РНК, причому ДНК віді-грає надзвичайно важливу роль в явищах спадковості та регуляції білко-вого обміну, а РНК – при здійсненні синтезу білкових речовин. Згідно з Уотсоном і Криком молекула ДНК – це два спіралеподібні ланцюги, що з’єднані між собою, головним чином, водневими зв’язками між нітритни-ми основами. Аналогічну роль відіграють водневі зв’язки і в молекулі РНК.
