
- •Природа хімічного зв’язку
- •1. Метод валентних зв’язків
- •2. Поняття про валентність
- •3. Властивості ковалентного зв’язку
- •4. Гібридизація атомних орбіталей і геометрична форма молекули
- •5. Делокалізовані p-зв’язки
- •6. Полярні і неполярні ковалентні зв’язки
- •7. Зарядність атомів
- •8. Окисне число
- •9. Донорно-акцепторний зв’язок
- •10. Водневий зв’язок
- •11. Іонний зв’язок
- •Сума зарядів
- •12. Зв’язок між будовою молекул та їх фізіологічною дією
- •13. Контрольні запитання
7. Зарядність атомів
У результаті хімічної взаємодії атомів і зовнішніх впливів на атомах локалізуються заряди. Розрізняють істинний, ефективний і формальний заряди.
Істинний (реальний) заряд іонізованого або поляризованого атома визначається його електростатичним впливом на пробний точковий заряд (наприклад, на електрон або протон), розміщений за межами електронних орбіталей даного атома. Якщо пробний заряд розміщується на будь-якій відстані від ядра в межах атома, то електростатичний вплив характеризує ефективний заряд.
Будь-який інший заряд частки, який не відповідає реальному значен-ню, називають формальним зарядом. Його приписують вільному атому або атому, який входить до складу молекули, після проведення над нею ряду умовних операцій. Для розрахунку формальних зарядів припускають, що сильно полярна молекула є чисто іонною. Шляхом уявного ділення молекули на складові виникають уявлення про іони, заряд яких вимі-рюється цілими окисними числами (ступенем окиснення). “Ступінь окис-нення” – менш вдале поняття, ніж “окисне число”, тому що окиснення (ре-альне розміщення зв’язуючих електронних пар біля атомів сполуки) визна-чити нині неможливо.
8. Окисне число
Окисне число є зарядом атома в молекулі, який йому приписують, виходячи із гіпотези про іонну будову сполуки. Окисне число – це фор-мальні заряди, які наближаються до істинних значень тільки для одно-атомних іонів стану ідеального газу.
Знаходження окисних чисел атомів у полярних молекулах чи іонах базується на тому, що молекула в цілому повинна бути електрично ней-тральною. При цьому використовують деякі правила.
1. Окисне число елемента у вільному стані чи в складі простої речовни дорівнює нулю.
2. Окисне число елемента у стані одноатомного іона в іонній сполуці дорівнює електростатичному заряду цього іона.
3. Окисне число елемента в складних сполуках знаходять на основі значень окисних чисел інших елементів, які входять до складу даної спо-луки. Деякі елементи мають постійні окисні числа, наприклад, Флуор (-1), Оксиген (-2), лужні метали (+1). Важливі виключення по відношенню до Оксигену складають пероксиди (-1), оксиген фторид (+2 в OF2). Окисне число Гідрогену приймають +1, за виключенням гідридів, в яких воно дорівнює -1. Для непарних молекул окисні числа умовні і не дають уяв-лення про справжнє розміщення електронів у сполуках, використання їх має відомий інтерес при вирішенні деяких питань хімії (для визначення еквівалентів речовин, енергії кристалічної ґратки і т. ін.).
9. Донорно-акцепторний зв’язок
Донорно-акцепторний зв’язок реалізується за рахунок неподіленої електронної пари, яку дає одна із атомно-молекулярних частинок, що вза-ємодіють, на вільну орбіталь іншої. Для позначення даного типу зв’язку використовують також термін “координаційний зв’язок”. Частинку, яка віддає електронну пару, називають електронодонором, яка приймає її – електроноакцептором. Після взаємодії електронна пара знаходиться в спільному користуванні донора і акцептора. У ролі донорів найчастіше виступають атомно-молекулярні частинки, які складають атоми N, O, F, Cl, а у вигляді акцепторів – іони перехідних елементів.
Традиційним прикладом утворення донорно-акцепторного зв’язку є утворення амоній-іона з амоніаку, який має неподільну пару електронів, і протона, який має вакантну 1s-орбіталь:
![]() .
.
Донорно-акцепторний зв’язок майже завжди є полярним. Він відіграє важливу роль в утворенні комплексних сполук, іоно-молекулярних асоці-атів і агрегатів із водневим зв’язком.
До донорно-акцепторних зв’язків належать також деякі місткові зв’яз-ки, наприклад, у полімері PdCl2
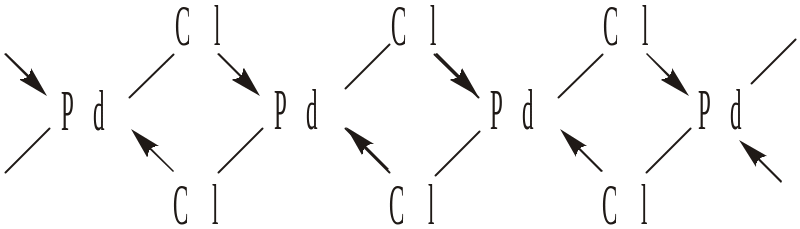
Стрілки і рисочки тут вказують на походження зв’язків, а не на їх різ-ницю. Стрілка вказує на те, що при утворенні зв’язків у подібних містко-вих сполуках атоми Хлору, крім свого неспареного електрона, викорис-товують ще свою неподільну пару електронів, а атоми Паладію в збудже-ному стані, крім своїх вільних валентних електронів, використовують ще вакантні р- і d-орбіталі.
