- •Природа хімічного зв’язку
- •1. Метод валентних зв’язків
- •2. Поняття про валентність
- •3. Властивості ковалентного зв’язку
- •4. Гібридизація атомних орбіталей і геометрична форма молекули
- •5. Делокалізовані p-зв’язки
- •6. Полярні і неполярні ковалентні зв’язки
- •7. Зарядність атомів
- •8. Окисне число
- •9. Донорно-акцепторний зв’язок
- •10. Водневий зв’язок
- •11. Іонний зв’язок
- •Сума зарядів
- •12. Зв’язок між будовою молекул та їх фізіологічною дією
- •13. Контрольні запитання
5. Делокалізовані p-зв’язки
Одне з основних положень методу валентних зв’язків свідчить, що електронний дуплет, який лежить в основі двоцентрового зв’язку, в моле-кулі речовини локалізований, тобто посідає в ньому чітко фіксоване поло-ження (лат. loco – місто, rocalis – місцевий, який знаходиться на визначе-ному місці). Однак щодо -зв’язків встановлено, що вони можуть одночас-но “обслуговувати” декілька атомів-партнерів.
Розглянемо такий
випадок – структуру карбонат-іона, який
виникає в процесі електролітичної
дисоціації карбонатної кислоти і її
розчинних солей, наприклад, Na2CO3
![]() 2Na+
+ CO3-2.
Карбонат-іон вміщує три атоми Оксигену,
з яких кожний у
своїй оболонці має по два неспарених
електрони:
2Na+
+ CO3-2.
Карбонат-іон вміщує три атоми Оксигену,
з яких кожний у
своїй оболонці має по два неспарених
електрони:
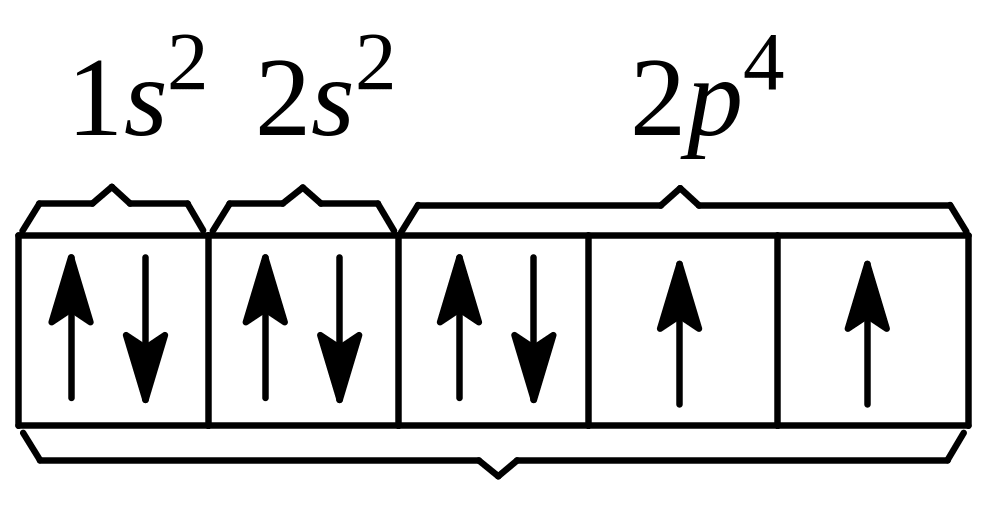
атом Оксигену.
А усього шість таких електронів. Два з них насичуються (переходять в електронні дуплети) за рахунок двох електронів атома Натрію, які переда-ються Оксигену в процесі дисоціації:
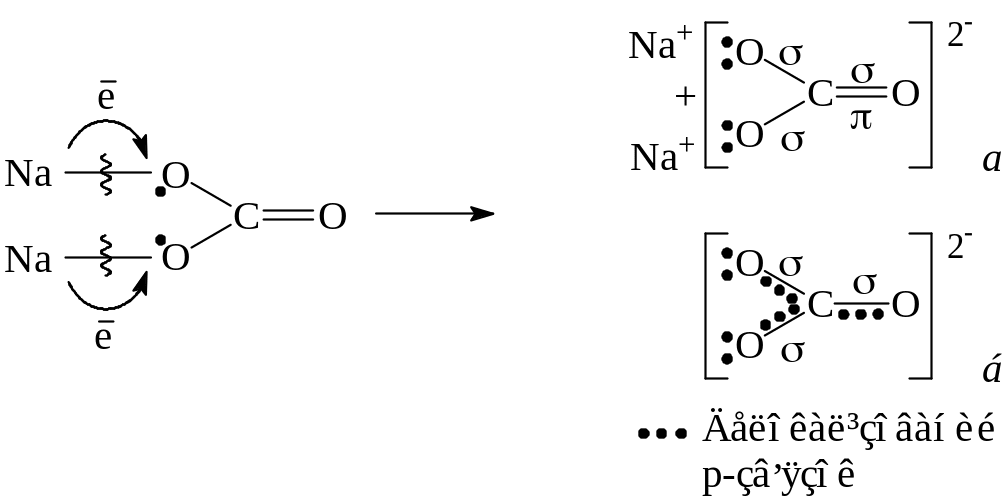
Інші три з трьома sp2-гібридними атомами Карбону утворюють 3-зв’язки (С–О). Таким чином, із шести неспарених електронів у трьох атомів Оксигену спарені п’ять (утворилось п’ять дуплетів). У Оксигену неспареним залишається один електрон. У Карбону також є один неспа-рений і негібридизований електрон (рz). Обидва вони утворюють -зв’я-зок. Як він розміщується в розглянутому атомі? Якщо так, як це показано на схемі (позиція а), тобто як двоцентровий локалізований другий зв’язок (-зв’язок) між атомами С і О, то тоді слід очікувати деякі відмінності в довжині і енергії трьох зв’язків С-О, які є в карбонат-іоні. Однак, як пока-зують експериментальні дані, всі три зв’язки зовсім рівноправні, нічим не відрізняються між собою і довжина всіх цих зв’язків однакова, складає 0,129 нм. Ця величина проміжна між одинарним (dc-o= 0,143 нм) і подвій-ним (dc=o= 0,122 нм) зв’язками. Все це говорить про те, що -зв’язок дело-калізований і однаково “обслуговує” усі три атоми Оксигену – зв’язок трицентровий: негативний заряд -хмари розташовується по всьому кар-бонат-іону. Делокалізований зв’язок прийнято відмічати пунктиром і фор-мулу карбонат-іона слід записувати так, як це показано вище (позиція б). Кратність зв’язків С-О більше одиниці, але менше двох і за підрахунками дорівнює 11/3.
Утворення
делокалізованого -зв’язку
призведе
до витіснення карбо-нат-іона у водних
розчинах солей карбонатної кислоти,
аналогічна картина спостерігається у
відношенні аніонів майже усіх
оксигеновмісних кислот (![]() і т.ін.).
і т.ін.).
У хімії добре відомий факт значно більшої стійкості атомів солей малостійких кислот, а особливо тоді, коли сіль утворена активним (на-приклад, лужним) металом. Так, кислоти H2CO3, HNO2, HMnO4 і т.д. не можуть бути отримані у чистому (100%-вому) вигляді. При концентру-ванні водних їх розчинів вони розкладаються. Солі цих же кислот (K2CO3, KNO2, KMnO4) стійкі і можуть бути отримані у кристалічному вигляді. Цей факт пов’язують з утворенням в аніонах солей делокалізованого -зв’язку.
6. Полярні і неполярні ковалентні зв’язки
Якщо двохатомна молекула складається з атомів одного елемента, наприклад, молекули H2, N2, Cl2 і т.ін., тоді кожна електронна хмара, утво-рена загальною парою електронів і спроможна утворити ковалентний зв’я-зок, розміщується в просторі симетрично щодо ядер обох атомів. У по-дібному випадку ковалентний зв’язок називається неполярним чи гомео-полярним. Якщо ж двохатомна молекула складається з атомів різних еле-ментів, тоді спільна електронна хмара зміщена в бік одного з атомів, так що виникає асиметрія в розміщенні заряду. В таких випадках ковалентний зв’язок називається полярним чи гетерополярним.
Для оцінювання здатності атома даного елемента притягувати до себе спільну електронну пару користуються величиною – відносною електроне-гативністю.
Полярний ковалентний зв’язок утворюється між атомами різних еле-ментів із різною відносною електронегативністю. В цьому випадку зв’язу-юча електронна хмара зміщується до більш електронегативного атома. Прикладом можуть слугувати молекули легких неорганічних сполук: HCl, H2O, H2S, NH3 і інших. Утворення молекули HCl можна уявити за схемою:
![]() або
Н+Сl–.
або
Н+Сl–.
Електронна пара зміщена до атома Хлору, тому що відносна електро-негативність атома Хлору більша, ніж атома Гідрогену (2,83 і 2,1 відпо-відно).
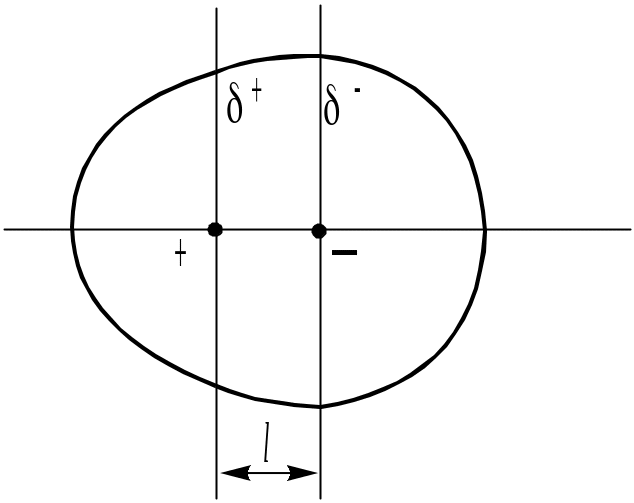
Зміщення зв’язуючої електронної хмари називається поляризацією. Як результат односторонньої поляризації в молекулі НСl електронна густина навколо ядра Хлору вища, ніж навколо ядра Гідрогену. Електричні центри тяжіння позитивних і негативних зарядів у молекулі не співпадають в одній точці. Вони знаходяться на деякій відстані l (рис. 22).
Молекула є маленьким електричним диполем з зарядом - у атома Хлору і + – у атома Гідрогену. Такі зв’язки і молекули називають полярними або гетерополярними. Заряди атомів у молекулі на-зивають ефективними зарядами (вони менше одиниці: в молекулі НСl Сl = -0,18, Н = +0,18 заряду електрона). Кількісною мірою полярного зв’язку (як і по- |
Рис. 22. Полярна моле-кула з постійним елек-тричним моментом диполя |
лярності молекули) є електричний момент диполя р, величина якого задається відношенням:
р = ´ l, (23)
де – ефективний заряд, l – довжина диполя, тобто відстань між центрами тяжіння позитивних і негативних зарядів. У СІ одиницях електричний мо-мент диполя виражається в дебаях (D): 1D = 3,33 10-30 Кл м.
Електричний момент диполя – векторна величина. Напрямок його умовно приймають від позитивного заряду до негативного – в бік зміщен-ня зв’язуючої електронної хмари. За величиною і напрямком р до деякої міри можна судити про геометричну будову молекули. Наприклад, р моле-кули SO2 дорівнює 5,36 ´ 10-30 Кл × м. Ймовірно, вона, як і молекула води, повинна мати кутову будову.
Молекули, які мають неполярний ковалентний зв’язок, називають неполярними. У таких молекул зв’язуюча електронна хмара розміщується симетрично між ядрами обох атомів і ядра рівною мірою діють на неї. Прикладом можуть слугувати молекули простих речовин, тобто які скла-даються з атомів одного і того ж елемента H2, F2, Cl2, O2 та інші.
Електричний момент диполя у таких молекул дорівнює нулю. Як уже відзначалось, до неполярних належать і більшість симетрично побудо-ваних молекул складних речовин, хоча зв’язки між атомами у них полярні. Речовин з неполярним ковалентним зв’язком порівняно небагато.