- •Природа хімічного зв’язку
- •1. Метод валентних зв’язків
- •2. Поняття про валентність
- •3. Властивості ковалентного зв’язку
- •4. Гібридизація атомних орбіталей і геометрична форма молекули
- •5. Делокалізовані p-зв’язки
- •6. Полярні і неполярні ковалентні зв’язки
- •7. Зарядність атомів
- •8. Окисне число
- •9. Донорно-акцепторний зв’язок
- •10. Водневий зв’язок
- •11. Іонний зв’язок
- •Сума зарядів
- •12. Зв’язок між будовою молекул та їх фізіологічною дією
- •13. Контрольні запитання
2. Поняття про валентність
Найважливішим поняттям хімії є валентність, яку нерідко для одно-атомних іонів порівнють із зарядністю, що недопустимо. За сучасними уявленнями, валентність атома, одноатомного іона або радикалу визнача-ється числом його неспарених електронів, неподільних електронних пар і вакантних орбіталей в основному або інших збуджених станах, які беруть участь в утворенні хімічних зв’язків. Можна запропонувати наступне ви-значення валентності.
Валентність атомних частинок – це їх властивість вступати в хімічну взаємодію, кількісною характеристикою якої є сумарне число неспарених електронних, неподільних електронних пар і вакантних орбіталей, які бе-руть участь в утворенні хімічного зв’язку.
Валентність атомної частинки не є сталою величиною. Вона може змі-нюватися від одиниці до деякого максимального значення (максимальної валентності) у залежності від природи частин-партнерів і умов утворення хімічної сполуки. Максимальна валентність реалізується при утворенні хімічного зв’язку шляхом використання усіх можливостей у системі.
Кількість хімічних зв’язків, утворених атомною частиною в ковалент-них сполуках, визначається числом орбіталей, які беруть участь в утво-ренні зв’язків. Наприклад, у молекулі F2 валентність Флуору приймають за одиницю, тому що в утворенні одинарного хімічного зв’язку F–F бере участь одна 2р-орбіталь. Ця орбіталь займається парою зв’язаних елект-ронів. В СН, СН2, СН3 і СН4 валентність Карбону приймає значення від 1 до 4. Валентність 4 є для Карбону максимальною і визначається чотирма sp3-гібридними орбіталями, здатними брати участь в утворенні хімічного зв’язку.
В іонах і деяких інших сполуках визначення валентності атомно-моле-кулярних часток зустрічає деякі труднощі. У цих сполуках неможливо підрахувати валентність за кількістю зв’язуючих орбіталей, тому що вони відсутні. У них валентність визначається числом іонів, які знаходяться в найближчому оточенні даного іона (у контакті з ним), тобто коорди-наційним числом іона в кристалі. Тоді в іонній парі Na+Cl- (г) натрій-іон буде одновалентним, тому що контактує тільки з одним хлорид-іоном. У кристалі Na+Cl- (тв.) натрій-іон буде мати валентність, що дорівнює 6, у відповідності з координаційним числом Na+ в кристалі. Однак ненасиче-ність іонного хімічного зв’язку (на відміну від насиченого ковалентного зв’язку) робить оцінку валентності за допомогою координаційного числа, в значній мірі, умовною.
3. Властивості ковалентного зв’язку
Характерні властивості ковалентного зв’язку – довжина, енергія, наси-ченість та напрямленість.
Довжина зв’язку – відстань між ядрами атомів у молекулі, яка визна-чається експериментально. Хімічний зв’язок стійкіший, коли менша його довжина. Однак мірою міцності зв’язку є енергія зв’язку.
Енергія зв’язку визначається кількістю енергії, яка необхідна для роз-риву зв’язку. Звичайно, вона вимірюється в кілоджоулях, віднесених до 1 моля речовини. Так, за експериментальними даними, довжини зв’язку мо-лекул Н2, Сl2 і N2 відповідно складають 0,074, 0,198 і 0,109 нм, а енергії зв’язків дорівнюють 436, 242 і 946 кДж/моль. Зі збільшенням кратності, енергія зв’язку збільшується, а довжина – зменшується.
Насиченість – це здатність атомів утворювати обмежену кількість ковалентних зв’язків. Наприклад, неможливо приєднати ще атом Гідро-гену до молекули Н2 або НCl, тому що спін електрона атома Гідрогену стане паралельним спіну одного з електронів у зв’язуючій електронній па-рі і виникає відштовхування. Завдяки насиченості зв’язків молекули ма-ють визначений склад: H2, а не Н3; НCl, а не Н2Сl і т. ін.
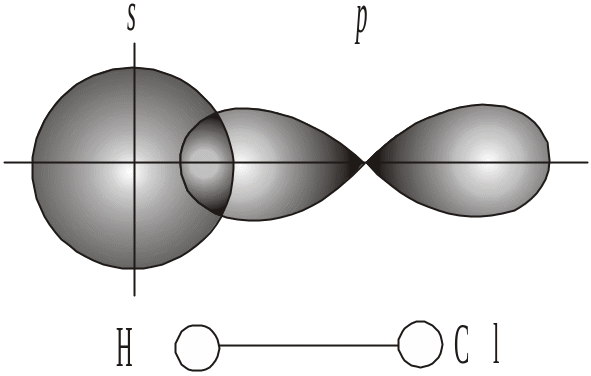
Напрямленість ковалентного зв’язку обумовлює просторову струк-туру молекул, їх геометрію (форму). Розглянемо це на прикладі утворення молекул НСl, Н2О і NH3. Ковалентний зв’язок виникає у напрямку макси-мального перекривання електронних хмар (орбіталей) вздовж лінії атомів, які взаємодіють. У разі утворення молекули НСl відбувається перекриван-ня s-орбіталі атома Гідрогену з р-орбіталлю атома Хлору. Молекула має лінійну форму (рис. 14а).
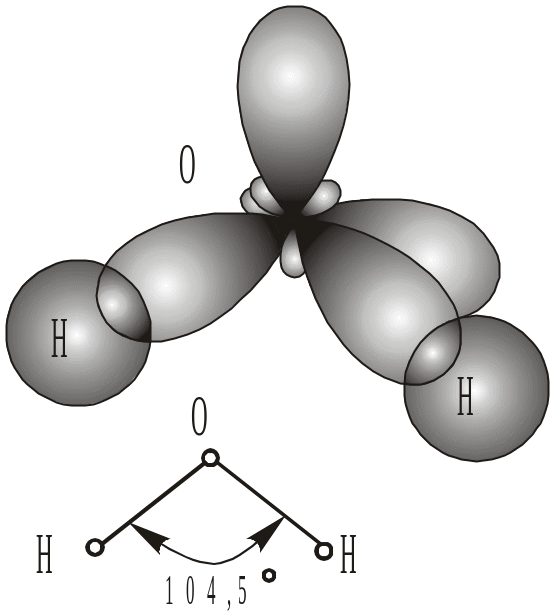
На зовнішньому рівні атома Оксигену знаходяться два неспарених електрони. Орбіталі їх взаємно перпендикулярні, тобто знаходяться від-носно один одного під кутом 90°. При утворенні молекули води орбіталь кожного р-електрона перетинається орбіталлю 1s-електрона атома Гідро-гену по лінії осей координат у місці, позначеному більш густими крап-ками (рис. 14б).
|
|
а |
б |
Рис. 14. Схема утворення молекули: а – HCl; б – Н2О |
|
Хімічні зв’язки у цьому випадку повинні бути спрямовані під кутом 90°. Експериментально знайдено, що кут між зв’язками в молекулі води Н–O–Н дорівнює 104,5, що пояснюється гібридизацією орбіталей.
Таким чином, атом Оксигену з двома валентними р-електронами утво-рює зігнуту (кутову) молекулу води. Ймовірно, такі ж зігнуті молекули (але з іншою величиною кута) повинні утворювати з Гідрогеном аналоги Оксигену – Сульфур, селен, телур.
В утворенні молекули NH3 беруть участь три неспарених р-електрони атома Нітрогену, електронні орбіталі яких також взаємно перпендикуляр-ні, і 1s-електрони трьох атомів Гідрогену. Як видно з рис. 15, зв’язки роз-
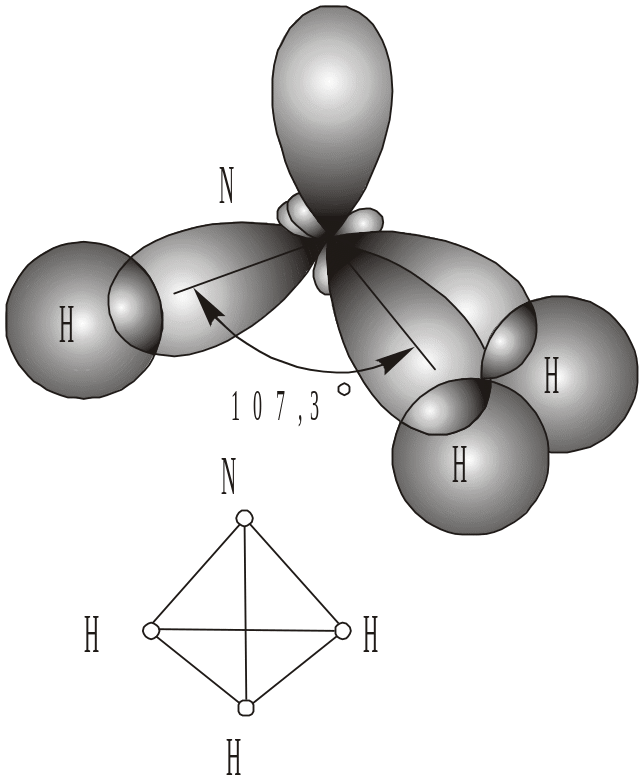
Рис. 15. Схема утворення молекули NH3
міщуються вздовж осей р-орбіталей. Молекула має форму правильної пі-раміди: в кутах трикутника знаходяться атоми Гідрогену, у вершині піра-міди – атом Нітрогену. Кут між зв’язками Н–N–H дорівнює 107,3. Моле-кули такої ж форми (але з іншою величиною кута) будуть утворювати з Гідрогеном аналоги Нітрогену – Фосфор, Арсен, Стибій.
Ковалентні зв’язки, утворені багатовалентними атомами, завжди мають просторову напрямленість, між напрямами ковалентних зв’язків такого атома утворюється валентний кут.