
- •Должность, ученая степень, ученое звание, воинское звание, инициал имени, фамилия автора (авторов)
- •(Номер по тематическому плану изучения дисциплины) по дисциплине: «Биохимия»
- •(Наименование учебной дисциплины)
- •1. Общие принципы регуляции путей метаболизма
- •1.1. Равновесные и неравновесные реакции
- •1.2 Определяющая скорость реакция метаболического пути
- •2. Регуляция метаболизма углеводов
- •Гликолитическая оксидоредукция
- •Обращение гликолиза
- •3. Регуляция глюконеогенеза (обращение гликолиза).
- •4. Регуляция окислительного декарбоксилирования
- •5. Регуляция цикла трикарбоновых кислот
- •6.Пентозофосфатный цикл (гексозомонофосфатный путь метаболизма глюкозы).
- •7. Регуляция процессов синтеза и распада гликогена
- •8. Регуляция концентрации сахара в крови
- •1. Углеводы, содержащиеся в пищевом рационе.
- •3. Гликоген печени
- •9.Механизмы развития гипергликемии и гипогликемии
- •10. Сахарный диабет
1. Общие принципы регуляции путей метаболизма
Регуляция скорости протекания реакций определенного метаболического пути часто осуществляется путем изменения скорости одной или, возможно, двух ключевых реакций, катализируемых «регуляторными ферментами». Некоторые физико-химические факторы, контролирующие скорость ферментативной реакции, например концентрация субстрата, имеют первостепенное значение при регуляции общей скорости образования продукта данного пути метаболизма[1,2,6,10]. В то же время другие факторы, влияющие на активность ферментов, например температура и рН, у теплокровных животных постоянны и практически не имеют значения для регуляции скорости процессов метаболизма.
1.1. Равновесные и неравновесные реакции
При достижении равновесия прямая и обратная реакции протекают с одинаковой
скоростью, и, следовательно, концентрации продукта и субстрата остаются постоянными. Многие метаболические реакции протекают именно в таких условиях, т.е. являются «равновесными».


 А В
С D
А В
С D
В стационарных условиях in vivo протекание реакции слева направо возможно за счет непрерывного поступления субстрата и постоянного удаления продукта D. Такой путь мог бы функционировать, но при этом оставалось бы мало возможностей для регуляции его скорости путем изменения активности фермента, поскольку увеличение активности приводило бы только к более быстрому достижению равновесия.
В действительности в метаболическом пути, как правило, имеются одна или несколько реакций «неравновесного» типа, концентрации реактантов которых далеки от равновесных. При протекании реакции в равновесном состоянии происходит рассеивание свободной энергии в виде теплоты, и реакция оказывается практически необратимой.
 тепло
тепло



 А
В
С
D
А
В
С
D
Неравновесная реакция
По такому пути поток реактантов идет в определенном направлении, однако без системы контроля наступит его истощение. Концентрации ферментов, катализирующих неравновесные реакции, обычно невелики, и активность ферментов регулируется специальными механизмами; эти механизмы функционируют по принципу «одноходового» клапана и позволяют контролировать скорость образования продукта [6].
1.2 Определяющая скорость реакция метаболического пути
Определяющая скорость реакция—это первая реакция метаболического пути, фермент которой насыщается субстратом. Она может быть определена как «неравновесная» реакция, характеризующаяся величиной Км, значительно меньшей, чем нормальная концентрация субстрата [1,6,8]. Первая реакция гликолиза, катализируемая гексокиназой ,является примером такой определяющей скорость реакции.
МЕТАБОЛИЧЕСКИЙ КОНТРОЛЬ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Гипотетический путь метаболизма, включающий стадии А, В, С, D, показан на схеме , на этом пути реакции А ↔ В и C↔ D являются равновесными, а реакция В → С—неравновесной. Скорость потока в таком метаболическом пути может регулироваться доступностью субстрата А. Это зависит от его поступления из крови, что в свою очередь зависит от количества пищи, поступившей в кишечник, или же от скоростей некоторых ключевых реакций,в результате которых основные субстраты высвобождаются и поступают в кровь, где их концентрация поддерживается на определенном уровне. Примерами могут служить пусковая реакция, катализируемая фосфорилазой печени, которая обеспечивает кровь глюкозой, а также реакция, катализируемая гормонзависимой липазой жировой ткани, поставляющая свободные жирные кислоты. Скорость процесса зависит также от способности субстрата А проникать через клеточные мембраны, от эффективности удаления конечного продукта D и от доступности косубстратов или кофакторов, обозначенных X и Y на схеме.
Ферменты, катализирующие неравновесные реакции, чаще всего являются аллостерическими, и их регуляция быстро осуществляется по принципу «обратной связи» или «прямой связи» под действием аллостерических модуляторов в ответ на потребности клетки. Другие механизмы регуляции, связанные с действием гормонов, обеспечивают потребности организма в целом. Гормональная регуляция осуществляется с помощью нескольких механизмов, одним из которых является ковалентная модификация фермента путем фосфорилирования и дефосфорилирования. Этот процесс протекает быстро; одной из промежуточных стадий часто является образование цАМФ, который в свою очередь стимулирует переход фермента из одной (например, неактивной) формы в другую. В процессе участвуют далее цАМФ-зависимая протеинкиназа, которая катализирует фосфорилирование фермента, или специфические фосфатазы, катализирующие его дефосфорилирование. Активной формой может быть либо фосфорилированный фермент, как в случае ферментов, катализирующих пути катаболизма (например, фосфорилаза а), или дефосфорилированный фермент, как в случае ферментов, катализирующих процессы биосинтеза (например, гликогенсинтаза a).
Фосфорилирование некоторых регуляторных ферментов может осуществляться без участия цАМФ и цАМФ-зависимой протеинкиназы. Фосфорилирование этих ферментов зависит от таких метаболических сигналов, как изменение соотношения [ATФ]/[AДФ] (пример—пируватдегидрогеназа) или активность Са2+/кальмодулинзависимых протеинкиназ (пример—киназа фосфорилазы) [6].
Синтез ферментов, контролирующих скорость метаболических путей, может изменяться под действием гормонов. Поскольку в этом случае происходит синтез новых белковых молекул, изменение активности происходит сравнительно медленно и чаще всего в ответ на изменение количества и состава поступающей пищи. Гормоны могут действовать как индукторы или репрессоры синтеза мРНК в ядре или как стимуляторы стадии трансляции белкового синтеза на уровне рибосом [8].
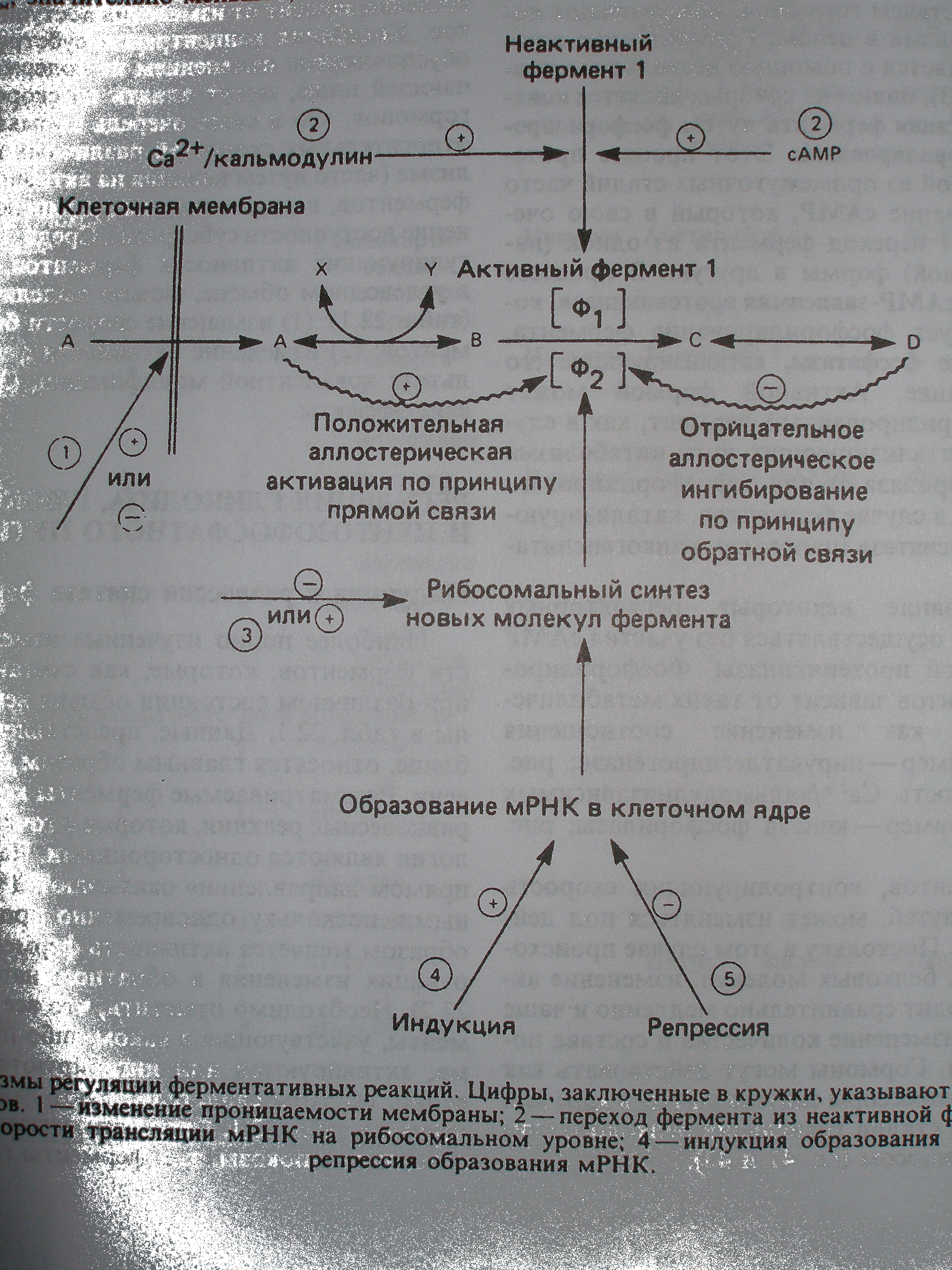
Рис.1. Механизмы регуляции ферментативных реакций [6].
Цифры, заключенные в кружки. Указывают вероятные участки действия гормонов. 1-изменение проницаемости мембраны; 2-перход фермента из неактивной формы в активную; 3- изменение скорости трансляции мРНК на рибосомальном уровне; 4- индукция образования новой мРНК; 5-репрессия образования мРНК.
РЕГУЛЯЦИЯ МЕТАБОЛИЗМА УГЛЕВОДОВ НА КЛЕТОЧНОМ И ФЕРМЕНТНОМ УРОВНЕ
Значительные нарушения метаболизма у животных при изменении состава пищи или баланса гормонов можно изучать, наблюдая за динамикой концентрации метаболитов в крови. Можно также изучать влияние этих изменений на отдельные органы, используя метод катетеризации, который позволяет измерять артериовенозную разницу концентраций исследуемого метаболита, Изменения метаболизма у интактных животных обусловлены часто дисбалансом обменных процессов в отдельных тканях, что обычно связано с изменением доступности метаболитов или изменением активности ключевых ферментов.
Большинство изменений метаболизма прямо или косвенно зависит от изменения доступности субстратов. Колебания концентрации субстратов в крови, обусловленные изменением их содержания в поступающей пище, могут влиять на скорость секреции гормонов, что в свою очередь вызывает изменения относительных скоростей различных путей метаболизма (часто путем влияния на активность ключевых ферментов, в результате чего компенсируется изменение доступности субстрата). Среди механизмов, регулирующих активность ферментов, участвующих в углеводном обмене, можно выделить три группы: (1) изменение скорости биосинтеза ферментов; (2) изменение активности фермента в результате ковалентной модификации; (3) аллостерические эффекты [6].
ОБМЕН УГЛЕВОДОВ
Углеводы - класс органических соединений, имеющих характер сахаров или близких к сахарам по строению и химическим свойствам. Наряду с белками и жирами углеводы играют важнейшую роль в обмене веществ и энергии в организме человека и животных. Они входят в состав растительных, животных и бактериальных организмов составляют абсолютное большинство органических природных соединений. Углеводы играют важную роль как основной строительный материал растений, скелета насекомых и других организмов.
Все основные углеводы гетеротрофные организмы получают с пищей. В процессе усвоения пищи все экзогенные полимеры углеводной природы расщепляются до мономеров, что лишает эти полимеры видовой специфичности, а во внутреннюю среду организма из кишечника поступают лишь моносахариды и их производные;
Моносахариды и их производные выполняют 3 основные функции:
Энергетическая функция: окислительное расщепление этих соединений дает организму 55-60 % необходимой ему энергии.
Из промежуточных продуктов ее окисления синтезируется много различных
соединений, необходимых клетке:
а)Глюкозо-6-фосфат используется в клетке для синтеза пентоз и глюкуроновой кислоты;
б)Фруктозо-6-фосфат - для синтеза аминосахаров;
в)ФГА и ФДА - для образования 3-фосфоглицерола, необходимого для синтеза глицеролсодержащих липидов;
г)3-фосфоглицериновая кислота - для синтеза заменимых аминокислот: серина, глицина и цистеина;
д)ФЭП - для синтеза сиаловых кислот, используемых при синтезе гетероолигосахаридов;
е)пируват - для синтеза аланина;
ж)ацетил-КоА - для синтеза жирных кислот и стероидов.
Безусловно, этот перечень может быть продолжен. Важно отметить, что атомы углерода из молекулы глюкозы могут оказаться в составе соединений различных классов, что было однозначно доказано с помощью метода меченых атомов [1].
3.И последнее - моносахариды и их производные осуществляют структурную функцию, являясь мономерными единицами других, более сложных молекул, таких как полисахариды или нуклеотиды.
