
- •Содержание
- •Часть 1. Предмет патологии. Учение о болезни (Куликов в.П., Доронина н.Л.)... 8
- •Часть 2. Механизмы развития болезней (Куликов в.П., Доронина н.Л.) 15
- •Часть 3* Патология органов и систем (Куликов в.П., Доронина н.Л.) 157
- •Часть 4. Ситуационные задачи (Куликов в.П., Костюченко л.А., Доронина н.Л,
- •Часть 5. Тестовые задания (Куликов в.П., Костюченко л.А., Воронцов в.В.,
- •Часть 6. Задания для подготовки к занятиям. Вопросы к экзамену (Куликов в.П.,
- •Часть 1. Предмет патологии. Учение о болезни.
- •I. Предмет патологии.
- •IIII Понятие болезни. Патологические реакции, процессы, состояния. Симптом и синдром. Классификация, стадии развития и исходы болезней.
- •IV. Умирание. Терминальные состояния.
- •VI. Патогенез заболеваний. Саногенез.
- •VII. Лечение заболеваний
- •Часть 2. Общая патология. 2.1 .Повреждение клетки.
- •IV. Общий адаптационный синдром. Схема развития симпато-адреналовой и гипоталамо-гипоФизарно-адреналовой реакций при стрессе. Стресс-реализующие и стресс-лимитирующие системы.
- •Стадии стресса или общего адаптационного синдрома:
- •V. Дистресс Болезни адаптации. Ятоогенные осложнения вследствие использования аналогов стресс-реализующих гормонов.
- •IV. Механизм Формирования патологии у плода при алкоголизме беременной женщины.
- •V. Методы изучения наследственных болезней.
- •2.4. Нарушение регионального кровообращения. Тромбозы и эмболии.
- •7. Характер движения крови по сосудам:
- •IV. Виды региональных нарушений кровообращения и их механизмы. Сладж-Феномен.
- •V. Методы оценки сосудистой гемодинамики.
- •2.5. Патология гемостаза.
- •V. Гипокоагуляиии. Связанные с дефицитом плазменных прокоагулянтов
- •2.6. Гипоксия.
- •I. Понятие гипоксии.
- •V. Адаптивные реакции организма: срочные и долговременные (дыхательные, гемодинамические, гемические, тканевые). Срочная адаптация к гипоксии (или 1-ая стадия долговременной адаптации)*
- •2.7. Патофизиология боли.
- •II. По характеру:
- •III. Понятия обморока и коллапса. Отличия от шока.
- •IV. Кома. Этиология и патогенез отдельных видов ком (печеночная, уремическая, диабетическая).
- •2.9. Воспаление.
- •III. Стадии опухолевого роста.
- •IV. Свойства опухолевого роста.
- •V. Опухолевые маркеры. Механизмы изменения иммунного надзора при
- •2.13. Патология углеводного обмена. Сахарные диабеты.
- •IV. Нарушение платочного метаболизма липидов. Жировая инфильтрация органов.
- •V Этиология и патогенез атеросклероза. Стадии развития атеросклероза и осложнения.
- •2.15. Патология белкового обмена.
- •IV. Вторичные нарушения обмена аминокислот. Патология конечных этапов белкового обмена, роль печени и почек е метаболизме аммиака. Нарушение обмена пуриновых и пиримидиноеых оснований.
- •Часть 3. Патология органов и систем. 3.1. Патология красной крови.
- •IV. Этиология и патогенез гемолитических анемий.
- •2. Липидзависимые мембранопатии:
- •3. Ферментопатии:
- •4. Гемоглобинопатии:
- •V. Этиология и патогенез дизэритропоэтических анемий.
- •VI. Компенсаторные реакции организма при анемиях.
- •3.2. Лейкоцитозы и лейкопении. Лейкозы.
- •I. Лейкоцитозы.
- •IV. Лейкемоидные реакции. Виды. Причины возникновения.
- •V. Лейкозы. Общая характеристика,
- •I. По виду клетки-«родоначальницы» лейкоза:
- •VI. Лабораторная характеристика лейкозов. Отличия лейкозов от лейке-моидных реакций.
- •VII. Общие изменения е организме при лейкозах.
- •3.3. Сердечная недостаточность.
- •2. Гипертрофия левого предсердия
- •1. Гипертрофия правого желудочка
- •2. Гипертрофия левого желудочка
- •1, Нервная регуляция.
- •1А} Норма
- •IV, Диагностика аритмий.
- •3.7. Патология артериального давления и сосудистого тонуса.
- •Резервный
- •VI. Компенсаторные процессы при недостаточности внешнего дыхания.
- •IV. Расстройства функции тонкого и толстого кишечника: секреции, переваривания, всасывания и моторики.
- •1. Усиление перистальтики кишечника.
- •2. Ослабление перистальтики кишечника.
- •V. Нарушение барьерной функции кишечника. Дисбактеоиоз.
- •I Повышение проницаемости мембранПовреждение мембран клеток с их частичной или полной деструкцией
- •Часть 4. Ситуационные задачи.
- •Часть 5. Тестовые задания.
- •Часть 6. План практических занятий. Вопросы к экзамену. 6.1. План практических занятий по патофизиологии.
1, Нервная регуляция.
Симпатическая иннервация: имеются а- и р-адренорецепторы, последние пррнева-лируют. Стимуляция р-адренорецепторов сопровождается увеличением ЧС(Е и диаметра коронарных артерий.
Холинэргические влияния выражены в меньшей степени, сопровождаются расширением коронарных артерий (опосредовано стимуляцией М-холинорецепторов)
2. Гуморальная регуляция
Основные БАВ, участвующие в регуляции тонуса коронарных сосудов представлены в таблице 3.4.1.
Таблица 3.4Л. Гуморальные факторы, определяющие диаметр просвета коронарных артерий.
Гормоны
и биологически активные вещества
Метаболиты
I
9
О
о
о
о
3
1-н
Он
о
и о
с5
8 <
±
+
Примечание: «+» - сужение «-» - расширение.
//. Абсолютная и относительная коронарная недостаточность. Этиология и патогенез ишемической болезни сердца и инфаркта миокарда.
Коронарная недостаточность (КН) - несоответствие между доставкой к сердцу кислорода и субстратов обмена веществ по коронарным артериям и потребностями миокарда в них.
По скорости развития КН классифицируется на острую и хроническую.
КН - основная причина смерти в группе патологии сердечно-сосудистой системы, вместе с ишемической болезнью мозга составляет 90% смертности от сердечнососудистых заболеваний.
Абсолютная коронарная недостаточность - снижение доставки артериальной крови к миокарду по коронарным артериям, обусловленное уменьшением или полным закрытием просвета венечных артерий.
184
Причины, вызывающие абсолютную коронарную недостаточность, обозначают как коронарогенные (кардиалъные):
Атеросклероз коронарных артерий, вызывающий их гемодинамически значимый стеноз и окклюзию.— главная причина коронарной недостаточности.
Коронароспазм (спазм коронарных артерий), обусловленный увеличением адрено-реактивности сосудов миокарда (стенокардия Принцметалла).
Тромбоз коронарных артерий (чаще как осложнение их атеросклеротического поражения).
Снижение коронарного резерва наблюдается при нарушениях регуляции коронарного кровотока, из-за потери эластичности сосудистой стенки, гипертрофии миокарда.
Коронарный резерв способен обеспечивать увеличение потребления Ог от 10 мл/мин/100 г в покое до 65 мл/мин/100 г вещества миокарда, то есть коронарный резерв в норме равен 55 мл/мин/100 г
Субинтималъные кровоизлияния в стенку коронарных артерий.
Снижение перфузионного давления в коронарных артериях при значительной бра-ди- или тахикардии, трепетании / мерцании предсердий или желудочков, недостаточности аортальных клапанов, острой гипотензии, сдавлении венечных сосудов опухолью, рубцом, инородным телом и т.п.
Относительная коронарная недостаточность - существенное повышение «запроса» и расхода миокардом кислорода и субстратов метаболизма по сравнению с уровнем их притока на фоне нормальной или даже увеличенной перфузии.
Причины, вызывающие относительную коронарную недостаточность, обозначают как некоронарогенные (экстракардиальные).
Стресс и активация симпато-адреналовой системы вызывает повышение потребности миокарда в кислороде вследствие возбуждения |3-адренорецепторов миокарда; У пациентов с имеющимся атеросклеротическим поражением коронарных артерий, превалируют эффекты возбуждения а-адренорецепторов коронарных артерий (спазмУнад эффектами возбуждения р-адренорецепторов.
Артериальная гипертония, в соответствие с законом Анрепа (сила сердечных сокращений пропорциональна давлению = сопротивлению, против которого работает сердце), сопровождается увеличением потребности миокарда в кислороде.
Тиреотоксикоз (избыток тиреоидных гормонов повышает адренореактивность миокарда и непосредственно увеличивает силу и частоту сердечных сокращений).
4. Анемия (острая постгеморрагическая) - резкое снижение кислородной емкостикрови вызывает гемическую гипоксию и дефицит субстратов в миокарде.Ишемия миокарда - уменьшение притока артериальной крови к миокарду, следствием чего является снижение доставки к нему кислорода.
Гипоксия миокарда характеризуется недостаточностью биологического окисления вследствие неадекватности снабжения тканей сердца кислородом или нарушения его использования, поэтому она может развиваться при нормальном и даже повышенном коронарном кровотоке (из-за снижения насыщения крови кислородом).
Ишемическая болезнь сердца (ИБС) - недостаточность коронарного кровообращения, вызванная атеросклерозом, спазмом или тромбозом коронарных артерий;
Стенокардия (грудная жаба) - один из видов ИБС, основным симптомом которой является приступообразная боль за грудиной, обычно иррадиирующая в левую лопатку и руку. ':
В таблице 3.4.2. представлены функциональные классы стенокардии, определяемые на оснований толерантности к физической нагрузке.
185
Таблица 3.4:2, «Канадская» классификация функщональных классов стенокардии напряжения
|
Функциональный класс ,. |
Признаки |
|
!♦ . |
Редкие приступы при интенсивных нагрузках, физическая активность не ограничена. |
|
И. |
Приступы при быстрой ходьбе, подъеме по лестнице выше первого этажа, физическая активность несколько ограничена. | |
|
III. |
Приступы при обычной ходьбе на небольшое расстояние, выраженное ограниченное физической активности. |
|
IV. |
Приступы возникают при малейшей физической активности и даже в покое. |
В зависимости от течения выделяют стабильную и нестабильную стенокардию, а также вариантную стенокардию (особая, вазоспастичеекая, стенокардия Принцметала).
Инфаркт миокарда (ИМ) - возникновение некроза в сердце, обусловленное нарушением коронарного кровотока.
Различают крупноочаговый (трансмуральный) и мелкоочаговый (нетрансму-ральный) ИМ.
Факторы риска ИБС:
Артериальная гипертензия.
Ожирение и избыточная масса тела.
Гиподинамия.
Гиперхолестеринэмия и дислинопротеинемия.
Курение.
Стресс (стресс-коронарный тип А по Дженкинсону).
Наследственность и пол.
Патогенез ИБС и ИМ обусловлен развитием стадийного процесса: ишемия -» паранекроз -» некробиоз -» некроз и аутолиз -» исходы
Механизмы гибели клеток при инфаркте миокарда показаны на рисунке ЗАЛ. При развитии ИМ различают три зоны:
Зона ишемии - после восстановления кровоснабжения все изменения в ней подвергаются обратному развитию.
Зона ишемического повреждения (клетки в состоянии паранекроза и некробиоза) -после восстановления кровоснабжения часть этой зоны полностью восстанавливается, а часть некротизируется.
Зона некроза - зона необратимых изменений, которая подвергается аутолизу, дальнейшая судьба может быть различной (см. «Исходы инфаркта миокарда»). Исходы ИМ:
Рубцевание.
Образование сердечных аневризм.
Разрыв и тампонада сердца. Осложнения ИМ:
Аритмии.
Отрыв папиллярных мышц с развитием острой митральной регургитации.
Кардиогенный шок (пульсовое давление меньше 20 мм рт.ст.)
а) Болевой шок - рефлекторное торможение (запредельное) центров сосудистой регуляции -> сосудистая недостаточность.
б) Истинный шок - обусловлен снижением насосной функции сердца из-за повреждения 50-65% миокарда -» острая сердечная недостаточность.
в) Аритмический шок - обусловлен снижением насосной функции сердца из-за некоординированных сердечных сокращений -> острая сердечная недостаточность.
186
4. Постинфарктный синдром Дресслера (триада: плеврит, аллергический пневмонит, перикардит) развивается спустя 1 месяц и более после инфаркта миокарда, в основе лежит антигенное сходство некротизированных эндркардйальных клеток с кШтамй плевры, легкого и перикарда.
Р
:^ГЖ101^
■$ш&
/$|руса** обмен
^ШШробнмй
. Высвобождение Са~ из саркопяазматического
Т
Внеклеточный
'"% Вйутри1ше1гЬ#1Йй 1" ВйутриетШййный
Т Внутриклеточный
![]()
ПСПГ0ЙШ1Й&
Внутри^
КЙё1"рЧН1УЙ
I
^Конденсация хроматина * Денатурация белка
:
Аритмии
-^Щ^
; ■>■• ■:: ■ Ийбвй!» ;ШШШ': ■••;
Рис. 3.4.1. Механизмы гибели клеток при инфаркте миозшрда. При острой ишемии прекращается аэробный гликолиз и быстро падает клеточный запас АТФ. Это влечет за собой внутриклеточный ацидоз и нарушение АТФ-зависимых процессов, что в свою очередь вызывает накопление в клетке кальция, отек и гибель клетки [по Лилли Л., 2003].
///. Функциональная и лабораторная диагностика ИБО и ИМ. Электрокардиография
ЭКГ-признаки зон ИМ показаны на рис. 3.4.2.
зона ишемии {острая субэндокардиалъной ишемии): высокий, симметричный или глубокий отрицательный зубец Т. Нарушение биоэлектрических процессов и, прежде всего реполяризации.
зона повреждения (трансмуральнойишемии): смещение сегмента 8Т. Паранекроз, некроз, страдает фаза «плато» деполяризации.
зона некроза: патологический (3 (ширина более 0,03 с, амплитуда более 1/4 К) или С>8. Участок некроза не деполяризуется.
187

ОСТРАЯ
СУБЭНДОКАРДИАЛЬНАЯ
ИШЕМИЯ
"Коронарная" Т-волна
ТРАНСМУРА ЛЬНАЯ ИШЕМИЯ
подъем 8Т-сегмента
ТРАНСМУРА ЛЬНЫИ ИНФАРКТ
4 ■* 1 ** ** Патологический 0-зубец
Рис. 3.4.2. Схематическое изображение ЭКГ-признаков зон ИМ [по Могельванг И., 1998].
Стадии ИМ:
Острейшая: высокий симметричный зубец Т, смещение 8Т выше изолинии и его слияние с Т.
Острая: патологический С> или <38, смещение 8Т выше изолинии и его слияние с высоким Т (синдром Парди, крыло смерти, «кошачья спинка»).
Подострая: патологический (3 или <38, 8Т на изолинии. Т - отрицательный, глубокий.
Рубцовая: патологический С> или С>8, 8Т на изолинии, Т - слабоотрицательный, положительный или сглажен.
Схема изменений ЭКГ при остром ИМ с С2-зубцом показаны на рисунке 3.4.3.
Норма Острая Часы
Острая фаза
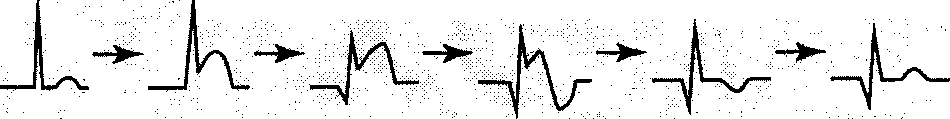
1-2 сутки Через несколько Через несколькодней недель
• Элевация ЗТ * Элевация 8Т ♦ Инверсия • Нормализация 8Т • Нормализация
Ф зубец В зубца Т * Отрицательный 8Т и Т
Появление зубца О# Углубление зубец Т •■ Сохраняется
зубца О зубец О
Рис. 3.4.3. Эволюция изменений ЭКГ при остром ИМ с р-зубцом [по Лилли Л., 2003].
Локализацию ИМ можно определить по комбинации отведений с патологическими изменениями (рис. 3.4.4.).
188
перёгородачйый
Нижний
(ЯШ
аУг)
ШреДН&ШрХуШШШ

Передний
Пёрвдне*бШшй
Задний
Шредне^йерёгарс^
ПередЙ^ре
Нижний
|
р,,,^^!^-,,,.,».,,,,,., Щ+ |
*Щ |
%г |
3-й- |
|
|
ХЛ4- |
у*\ |
*ц±; |
|
|
аУг |
|
^ |
Рис, 3.4.4; Топографическая диагностика ИМ. А - анатомические области сердца. В круглых скобках перечислены отведения, в которых появляются признаки инфаркта соответствующей области. Б - уменьшенная схематическая запись 12 отведений ЭКГ, показывающая стандартную ориентацию каждого отведения. Обозначены основные области левого желудочка. Заметим, что в то время как наличие патологических зубцов <3 в отведениях VI и У2 является признаком передне-перегородочного инфаркта, высокие начальные зубцы К в этих отведениях являются признаком инфаркта задней стенки [по Лилли Л., 2003].
Велоэргометрия (ВЭМ) - используется для установления скрытой ИБС и ее функционального класса.
Стресе-эхокардиография - используется для диагностики ИБС по нарушению подвижности стенки миокарда при нагрузке (чрезпищеводная стимуляция, ВЭМ, медикаменты).
Лабораторная диагностика.
При подозрении на наличие ИМ в клинической практике осуществляется определение следующих биохимических маркеров повреждения кардиомиоцитов:
КФК (в норме 0-10 нМ/см). Специфична для миокарда МВ-форма КФК, ее появление - ранний признак повреждения миокарда.
ЛДГ (в норме 3200 нМ/см). ЛДП и г - наиболее специфичные для кардиомиоцитов изоформы фермента,
Миоглобин.
Концентрация К+.
Особо специфично увеличение гликогенфосфорилазы, однако ее мало определяют.
Сердечные тропонины I и Т.
Тропониновый комплекс, регулирующий процесс мышечного сокращения в кардиомиоцитах, состоит из трех субъединиц: Т, I и С. Сердечные тропонины и тропонины скелетных мышц имеют различ-
189
ную аминокислотную последовательность, что позволяет создавать высокоспецифичные диагностику-мы для определения концентрации сердечных тропонинов I и Т в сыворотке крови. Сердечные тропонины при ИМ обычно достигают в крови больных диагностически значимого уровня через 6 ч после начала симптомов, повышенный их уровень сохраняется в дальнейшем в течение 7-14 суток, что делает их удобными для поздней диагностики ИМ. Из-за высокой специфичности и чувствительности определение сердечных тропонинов стало "золотым стандартом" в биохимической диагностике ИМ.
На рисунке 3А5. представлена динамика изменений концентрации сывороточных маркеров повреждения кардиомиоцитов.

1234 56 7 89 10
ДНИ ПОСЛЕ ИМ
Рис. 3.4.5. Динамика сывороточных маркеров острого ИМ. КФК (и ее изофермент КФК-МВ) повышается через несколько часов после острого ИМ и достигает пика через 24 часа; миоглобин начинает определяться в сыворотке раньше, но он менее кардиоспецифичен, Кардиоспецифичные тропонины обладают высокой чувствительностью и специфичностью в отношении повреждения миокарда и сохраняются в сыворотке в течение нескольких дней после острого ИМ, Уровень ЛДГ повышается более постепенно и достигает пика на 3-5 день после приступа [по Лилли Л., 2003].
3.5. Недостаточность мозгового кровообращения.
I. Анатомические и физиологические особенности мозгового кровообращения.
1. Развитая система анастомозов:
уровень Виллизиевого круга,
уровень коллатерального кровообращения на поверхности мозга в субарахнои» дальном пространстве,
анастомозы внутри какой-либо области, например, полушарий головного мозга,
внутримозговая капиллярная сеть,
* внечерепной уровень коллатерального кровообращения за счет анастомозирова-ния ветвей внутренней сонной артерии (ВСА) и ветвей позвоночной артерии (ПА) с бассейном наружной сонной артерии (НСА). Самым важным для поддержания адекватной внутримозговой гемодинамики при окклюзирующих поражениях брахиоцефальных артерий является Виллизиев круг.
2. Высокий уровень перфузии мозга. Мозг составляет всего лишь 2,0-2,5% от массы тела,однако, получает 15% крови от ОЦК.
190
Тонкая регуляция внутричерепного давления. Мозг расположен внутри ригидного черепа. Необходимый баланс между объемом крови и ликвора позволяет изменять приток крови к мозгу во избежание сдавления и ишемии мозговой ткани.
Относительная автономность нервной регуляции мозгового кровотока.
Высокая чувствительность мозговых сосудов к увеличению парциального давления С02 и снижению рН крови, которые направлены на уменьшение периферического сосудистого сопротивления и улучшение мозгового кровотока.
Величина прироста кровотока на вдыхание газовой смеси с повышенным содержанием СС>2 рассматривается как функциональный резерв мозгового кровообращения. Установлено, что у больных с нарушениями мозгового кровообращения реакция сосудов мозга на вдыхание СО2 снижена, извращена или отсутствует.
6. Артериальная гипертензия, как приспособительная реакция организма, встречается у20-30% больных с недостаточностью мозгового кровообращения.
Регуляция мозгового кровообращения.
Система регуляции мозгового кровообращения обеспечивает адекватность кровоснабжения мозга при изменениях его функциональной активности и независимость энергетического обеспечения мозга от различных внешних воздействий - феномен ауторегуля-ции.
Согласно установившимся представлениям, деятельность системы регуляции мозгового кровообращения основана на трех физиологических принципах: нейрогенном, метаболическом, миогенном.
Метаболическая ауторегуляция определяется балансом между метаболизмом в мозге и мозговым кровотоком в каждом отдельном участке. Увеличение концентрации в мозговой ткани С02, лактата, АДФ сопровождается расширением церебральных сосудов и увеличением кровотока.
Миогенная ауторегуляция базируется на особенностях сократительных свойств гладкомышечных элементов сосудистой стенки, определяющих ее способность активно отвечать на растягивающее усилие (эффект Бейлиса). При повышении АД резистивные сосуды суживаются, а при снижении АД - расширяются.
Нейрогенная ауторегуляция обусловлена преимущественно симпатическими нервными волокнами.
Механизмы ауторегуляции адекватно реализуются в пределах колебания системного АД от 60 до 180 мм рт.ст. (по систолическому АД). Временные характеристики становления феномена ауторегуляции лежат в пределах от 1-2 мин. до 25 с.
//. Этиология и патогенез нарушений мозгового кровообращения.
Недостаточность мозгового кровообращения (сосудистая мозговая недостаточность) - несоответствие между энергетическими потребностями мозга, в первую очередь в кислороде, и его доставкой по артериям мозга.
Ишемическая болезнь мозга (ИБМ) - различные поражения мозга, обусловленные недостаточностью его кровоснабжения.
Инсульт - острое нарушение мозгового кровообращения со стойкой неврологической симптоматикой и морфологическими изменениями в веществе мозга.
Ишемический инсульт - некроз вещества мозга вследствие ишемии (инфаркт мозга).
Геморрагический инсульт - некроз вещества мозга вследствие кровоизлияния в мозг.
Классификация нарушений мозгового кровообращения [по Шмидту Е.В. с сокращениями]
А. Начальные проявления недостаточности кровоснабжения головного мозга. В. Преходящие нарушения мозгового кровообращения (ПНМК).
Транзиторные ишемические атаки (ТИА).
Гипертензивные церебральные кризы. С. Инсульт.
191
Субарахноидальное нетравматическое кровоизлияние.
Геморрагический инсульт.
Ишемический инсульт (инфаркт).
Инсульт с восстановимым неврологическим дефицитом - малый инсульт.
Последствия ранее (более 1 года) перенесенного инсульта. В. Прогрессирующие нарушения мозгового кровообращения.
Дисциркуляторная энцефалопатия (атеросклеротическая, гипертоническая). Этиология нарушений мозгового кровообращения:
Атеросклероз.
Гипертоническая болезнь (эссенциальная гипертензия).
Болезни с симптоматической артериальной гипертензией.
Нейроциркуляторная дистония.
Артериальная гипотензия.
Поражения сердца и нарушения его деятельности (рис. 23.6.).
Аномалии сердечно-сосудистой системы (рис. 23.11.-23.17.).
Поражение легких, ведущее к легочно-сердечной недостаточности с нарушением венозного кровообращения в головном мозге.
Инфекционные и аллергические васкулиты.
Токсические поражения сосудов мозга.
Заболевания эндокринной системы.
Травматические поражения сосудов мозга и его оболочек.
Сдавление артерий и вен (при патологии позвоночника, опухолях и др.).
14. Болезни крови.Характер поражения сосудов:
Окклюзия просвета сосуда.
Сужение (стеноз) просвета сосуда.
Перегибы, петлеобразование сосудов.
Формирование аневризм.
Поражения вен и венозных синусов. Патогенетические механизмы ишемических поражений мозга.
Обычно рассматриваются два основных механизма ишемических поражений - эмболия и сосудистая мозговая недостаточность. В первом случае ишемические поражения мозга называют эмболическими, а во втором - гемодинамическими.
Развитие ишемических поражений мозга в большинстве случаев обусловлено эмболией, на долю же гемодинамических нарушений приходится 5-20% от общего числа всех ишемических поражений мозга, хотя при окклюзирующих поражениях артерий мозга преобладает гемодинамический механизм.
Последовательность метаболических реакций мозговой ткани на снижение кровотока через мозг показана в таблице 3.5 Л.
Стадии ишемии мозга представлены в таблице 3.5.2.
Уменьшение объема мозгового кровотока влечет за собой значительное ограничение поступления в ткань мозга кислорода и глюкозы. Критический дефицит кислорода и глюкозы регистрируется в центральной зоне ишемизированной территории.
Область мозга с наиболее выраженным снижением кровотока (менее 10 мл/100 г в 1 мин) становится необратимо поврежденной очень быстро, в течение 6-8 мин. с момента развития острого нарушения мозгового кровотока {«сердцевина» или «ядерная» зона ишемии). В течение нескольких часов центральный «точечный» инфаркт окружен ишемизированной тканью с уровнем кровотока выше 20 мл/100 г в 1 мин. - зона «ишемической полутени» или пенумбры (репитЪга). В этой зоне нейроны морфологически не изменены, но не функционируют. В зоне пенумбры сохраняется ионный гомеостаз нейронов и поддерживается трансмембранный потенциал покоя, но отсутствует спонтанная и индуциро-
192
ванная генерация потенциала действия. Нейроны пенумбры потенциально способны к восстановлению.
Вследствие того, что резерв локальной перфузии исчерпан, нейроны в области пенумбры становятся чувствительны к любому дальнейшему падению перфузионного давления, вызванному, например, вторичной гиповолемией, неадекватной гипотензивной терапией. За счет зоны пенумбры происходит постепенное увеличение размеров инфаркта. Зона «ишемической полутени» может быть спасена восстановлением адекватной перфузии ткани мозга, применением нейропротективных средств и является главной мишенью терапии в первые часы и дни после развития инсульта.
Если артериальная окклюзия носит временный характер или компенсаторно включается плотная коллатеральная сеть, то мозговой кровоток полностью или частично возвращается в ишемизированный участок.
|
Таблица 3.5.1. Последовательность метаболических реакций мозговой ткани на снижение кровотока [по Гусеву Е.И. и Скворцовой В.И., 2001, с изменениями]. | ||||
|
Критический уровень |
Величина снижения мозгового кровотока |
Реакции мозговой ткани | ||
|
в % от нормальной величины |
в мл на 100 г ткани мозга в 1 мин. | |||
|
Первый |
до 70-80 |
менее 50-55 |
Первая реакция в виде торможения белкового синтеза, она обусловлена рассредоточением рибосом, наблюдаемым на первых этапах ишемии. | |
|
Второй |
до 50 |
до 35 |
Активация анаэробного гликолиза, увеличение концентрации лактата, развитие лактат-ацидоза и тканевого цитотоксического отека. | |
|
Третий |
до 30 |
до 20 |
Снижение синтеза АТФ, формирование энергетической недостаточности, дисфункция каналов активного ионного транспорта, дестабилизация клеточных мембран и избыточное выброс возбуждающих аминокислот. | |
|
Необратимое поражение клеток |
до 20 |
до 10-15 |
Нейроны начинают терять ионные градиенты, и развивается аноксическая деполяризация мембран. 1 | |
|
Таблица 3.5.2. Стадии |
ишемии мозга [по Бэрону]. |
|
1 Стадия |
Состояние кровотока и метаболизма в мозге |
|
Вазодилатация |
Снижение перфузионного давления компенсируется за счет увеличение объема крови в мозге. |
|
Олигемия |
Мелкие внутричерепные артерии утрачивают способность к расширению, мозговой кровоток снижается; поддержание необходимого уровня потребления кислорода обеспечивается увеличением фракции извлечения кислорода, что получило название синдром «нищей перфузии». |
|
Истинная ишемия |1 [ |
Исчерпаны все возможные компенсаторные механизмы, уровень поглощения ки- 1 слорода снижается, что может привести к развитию инфаркта мозга. | |
Постигиемическая гиперемия («роскошная перфузия») возникает вследствие обильного поступления крови через коллатерали; реканализации закупоренной артерии; высвобождения из ишемизированной ткани вазоактивных и провоспалительных метаболитов; снижения вязкости крови; изменения нейрогенных вазодилататорных механизмов.
Увеличение мозгового кровотока после устранения окклюзии (спустя 2 мин. и более), на фоне уже запущенных ишемических процессов, не означает его нормализации.
Стадия постишемической гиперемии сменяется стадией постишемической гипо-перфузии (феномен «невосстановленного кровотока»). Происходит снижение мозгового кровотока ниже доишемического уровня вследствие отсроченных метаболических изменений в ишемизированной ткани: активация микроглии; синтез большого количества про-
193
воспалительных факторов (вызывают тяжелые изменения микроциркуляции, закупорку микроциркуляторного русла); повышение вязкости крови; повышение внутрисосудистой свертываемости крови; сдавление капилляров мозга гипергидратированными астроцита-ми; повышение внутричерепного давления.
В основе формирования очагового некроза на фоне ишемии мозга лежат реакции глутамат-кальциевого каскада, разворачивающиеся в первые минуты и часы после сосудистого инцидента. В его развитии выделяют три основных этапа: индукции (запуск), амплификации (усиление повреждающего потенциала) и экспрессии (конечные реакции каскада, непосредственно приводящие к гибели клетки).




Высвобождение
глютамата




Активация потенциалзави-симых кальциевых каналов
Активация
рецепторов ЫМРА и АМРА




Ацидоз
Повышение внутриклеточного кальция
Протеолиз






Синтез N0
Липолиз
Образование
свободных радикалов
Рис. 3.5.1. Упрощенная схема событий, возникающих при церебральной ишемии.
В 1994 г. 01пеу 1ЖЕ. выдвинул гипотезу «эксайтотоксической смерти нейронов», установив, что возбуждающим аминокислотным посредникам (глутамату и, возможно, аспартату) свойственна цитотоксичность. При их взаимодействии с перевозбужденными постсинаптичсскими рецепторами развиваются соматические поражения без изменений проводящей части нервной клетки. Условия, создающие такое перевозбуждение, характеризуются повышенным выделением и/или уменьшенным повторным захватом пе-
194
реносчика. Теория «эксайтотоксичности» могла объяснить гибель нейронов при различных заболеваниях головного мозга, в том числе и при ишемическрм инсульте (рис. 3.5.1.).
3.6. Аритмии.
Сердечные аритмии - нарушение частоты, ритмичности и последовательности сердечных сокращений.
/. Этиология аритмий.
Патология миокарда (миокардиты, кардимиопатии, миокардиодистрофии).
Коронарная недостаточность,
Дополнительные проводящие пути в сердце.
Травмы головного мозга, повышение внутричерепного давления, нарушения мозгового кровообращения.
Гипо- и гипертиреозы.
Токсические воздействия на миокард
Электролитные нарушения (гипо- и гиперкалиемия, гипомагниемия, гипер-кальциемия и др.).
//. Классификация аритмий.
Наибольшее распространение получило классифицирование сердечных аритмий по механизму их возникновения - в связи с нарушением автоматизма, возбудимости и проводимости в миокарде.
Классификация аритмий [по Кушаковскому М.С. и Журавлевой Н.Б., 1981, с изменениями].
1. Связанные с нарушением автоматии
А. Нарушения автоматизма синусового узла (номотопные аритмии)
Синусовая тахикардия
Синусовая брадикардия
Синусовая аритмия
Синдром слабости синусового узла
Б. Эктопические ритмы (гетеротопные аритмии) ш Предсердный ритм
Узловой (атриовентрикулярный) ритм
Идиовентрикулярный (желудочковый) ритм
Миграция суправентрикулярного водителя ритма
Атриовентрикулярная диссоциация
2. Связанные с нарушением возбудимости
Экстрасистолия
Пароксизмальная тахикардия
3. Связанные с нарушением возбудимости и проводимости -
Мерцание (фибрилляция) предсердий (мерцательная аритмия)
Трепетание предсердий
Трепетание и фибрилляция (мерцание) желудочков
4. Связанные с нарушением проводимости
Синоатриальная блокада
Межпредсердная блокада
11 Атриовентрикулярная блокада
Внутрижелудочковые блокады (блокады ветвей пучка Гиса).
Синдромы преждевременного возбуждения желудочков
а) Синдром Вольфа-Паркинсона-Уайта ОЛГРМУ).
б) Синдром укороченного интервала Р(^ (СЬС).
195
'"• Основные электрофизиологические механизмы аритмий: ано
мальный автоматизм, постдеполяризаиия. блокады, ре-энтри.
На рисунке 3.6.1. представлена схема строения проводящей системы сердца.

Рис. 3.6.1. Схема строения проводящей системы сердца [по ВиИоск В.Ь., 1996].
В специализированных и сократительных клетках сердца формируются два основных типа потенциала действия (ПД). Миокард предсердий, желудочков и специализированные волокна системы Гиса-Пуркинье, относятся к тканям с "быстрым ответом" (рис. З.6.2.). Для них характерна очень высокая скорость начальной деполяризации (фазы О ПД), которая обусловлена резко увеличивающейся проницаемостью мембраны для ионов Ш4* входящих по быстрым натриевым каналам внутрь клетки.
В клетках сино-атриального (СА) и атрио-вентрикулярного (АВ) узлов быстрые натриевые каналы отсутствуют. Поэтому деполяризация мембран этих клеток почти полностью определяется медленным входящим током Са2+. Поскольку интенсивность этого тока невелика, а его продолжительность достаточна, то фаза О ПД узловых клеток имеет относительно малую крутизну - клетки "медленного ответа" (рис. З.6.З.).
Фазы потенциала действия кардиомиоцита:
Фаза 0. Во время этой начальной фазы возбуждения - фазы деполяризации - резко увеличивается проницаемость мембраны клетки для ионов Ка , которые быстро устремляются внутрь клетки (быстрый натриевый ток) (рис. З.6.2.). При этом, естественно, меняется заряд мембраны: внутренняя поверхность мембраны становится положительной, а наружная - отрицательной. Величина ПД изменяется от -90 мВ до +20 мВ, т.е. происходит реверсия заряда - перезарядка мембраны. Продолжительность этой фазы не превышает 10 мс.
Фаза 1. Как только величина ПД достигнет примерно +20 мВ, проницаемость мембраны для Ш+ уменьшается, а для СГ увеличивается. Это приводит к возникновению небольшого тока отрицательных ионов СГ внутрь клетки, которые частично нейтрализуют избыток положительных ионов Иа внутри клетки, что ведет к некоторому падению ПД примерно до 0 или ниже. Эта фаза носит название фазы начальной быстрой реполяриза-ции.
Фаза 2. В течение этой фазы величина ПД поддерживается примерно на одном уровне, что приводит к формированию на кривой ПД своеобразного плато. Постоянный
196
уровень величины ПД поддерживается при этом за счет медленного входящего тока Са2+ и Ыа+, направленного внутрь клетки, и тока К+ из клетки. Продолжительность этой фазы велика и составляет около 200 мс. В течение фазы 2 мышечная клетка остается в возбужденном состоянии, начало ее характеризуется деполяризацией, окончание - реполяризаци-ей мембраны.
Фаза 3. К началу фазы 3 резко уменьшается проницаемость клеточной мембраны для Ыа+ и Са24" и значительно возрастает проницаемость ее для К+. Поэтому вновь начинает преобладать перемещение ионов К+ наружу из клетки, что приводит к восстановлению прежней поляризации клеточной мембраны, имевшей место в состоянии покоя: наружная ее поверхность вновь оказывается заряженной положительно, а внутренняя поверхность -отрицательно. ПД достигает величины потенциала покоя (ПП). Эта фаза носит название фазы конечной быстройреполяризации.
Фаза 4. Во время этой фазы ПД, называемой фазой диастолы, происходит восстановление исходной концентрации К+, Ка+, Са2*, С Г соответственно внутри и вне клетки благодаря действию «Ка+/К+-насоса». При этом уровень ПД мышечных клеток остается на уровне примерно -90 тУ.
Клетки проводящей системы сердца и клетки синусового узла обладают способностью к спонтанному медленному увеличению ПП - уменьшению отрицательного заряда внутренней поверхности мембраны во время фазы 4. Этот процесс получил название спонтанной диастолической деполяризации и лежит в основе автоматической активности клеток синоатриального (синусового) узла и проводящей системы сердца, т.е. способности к «самопроизвольному» зарождению в них электрического импульса.
^^^^Ж^»Ж^^^^^^^^^^Ш^^^%^^^^^^^^{бШ^

Рис. 3.6.2. Схема потенциала действия кардиомиоцита [по Шевченко Н.М. и Гроссу А.А., 1992]. А -потенциал действия и потенциал покоя; Б - рефрактерные периоды, АРП - абсолютный рефрактерный период, ОРП - относительный рефрактерный период; 0-4 - фазы потенциала действия.
197
Выход
К*
Фаза
4 деполяризации
МДП
Время
Рис. 3.6.3. Генерация потенциала действия в клетках-пейсмекерах [по Лилли Л., 2003], Фаза медленной деполяризации (фаза 4) обусловлена пейсмекерным током (I*), который уменьшает отрицательный мембранный потенциал до величины порогового потенциала (около -40 мВ). Быстрое начало потенциала действия связано с медленным входом ионов Са++ в клетку. Закрытие кальциевых каналов и выход К+ из клетки сопровождается реполяризацией мембраны. МДП - максимальный диастолический потенциал; ПП -пороговый потенциал.
Основные электрофизиологические механизмы возникновения аритмий суммированы на рисунке 3.6.4.
Тахиаритмии Щ;Чрс1чхШ^
I4
Автоматизма
Т Автоматизма ЭктоШйчвскйесинусового
узла лашн^ных Шаги
1
1
Трйггерная активность
• ■:-::'":'::".*.'-:";"-
Повторный
вход волны
возбу>*<Аен ия
(пз-ёгИгу)
'■■■■■■А-'-'
авто матизма
НАРУШШЙЯ


НАРУШЕНИЯ
ПРИВЕДЕНИЯ
ИМПУЛЬСА
^т
;::^;рвШ^^иШа1 синуш^Ьг0-узл4:-.
т
Блокада проведения ймяульса
Брадиаритмии (4- частоты им пульсации)
Рис. 3.6.4. Аритмии возникают в результате нарушения образования и/или проведения импульсов возбуждения. При тахиарнтмиях частота генерации потенциала действия увеличена, при брадиаритмиях, напротив, снижена [по Лилли Л., 2003].
198
А) Механизмы нарушений образования импульса.
7, Изменение нормального автоматизма СА-узла:
Изменение крутизны (скорости) спонтанной диастолической деполяризации: при ее возрастании пороговый потенциал возбуждения достигается быстрее и происходит учащение синусового ритма (тахикардия). Противоположный эффект, то есть замедление спонтанной диастолической деполяризации, ведет к замедлению синусового ритма (брадикардия).
Изменение величины мембранного ПП. Когда мембранный потенциал становится «более отрицательным» (при гиперполяризации клеточной мембраны, например, при действии ацетилхолина), требуется больше времени для достижения порогового потенциала возбуждения, если скорость спонтанной диастолической деполяризации остается неизменной. Следствием такого сдвига будет уменьшение ЧСС. При снижении мембранного потенциала покоя ЧСС, напротив, возрастает.
Изменения критического уровня деполяризации (КУД, порогового потенциала возбуждения). Его снижение (сдвиг в сторону более отрицательных значений) способствует учащению синусового ритма, а повышение - брадикардии. Величина порогового потенциала возбуждения кардиомиоцитов определяется свойствами Иа+-каналов, а клеток проводящей системы - Са2+-каналов. В связи с этим следует напомнить, что в основе фазы быстрой деполяризации в клетках рабочего миокарда лежит активация быстрых Ма+-каналов, а в клетках проводящей ткани сердца -Са2+-каналов.
2. Аномальный (эктопический) автоматизм - это появление пейсмекерной активности в клетках сердца, не являющихся водителями сердечного ритма.
Патологический автоматизм возникает в клетках при их частичной деполяризации (гипополяризация до 60-40 мВ). В норме эктопическая активность подавляется импульсами, поступающими из СА-узла, но при блокаде проведения импульса по предсердиям главным водителем ритма сердца может стать АВ-узел. Его способность к спонтанной деполяризации выражена меньше, чем в клетках СА-узла, поэтому в условиях поперечной блокады обычно развивается брадикардия.
Еще менее выражена способность к автоматизму у волокон Пуркинье. Однако эти волокна, как и другие клетки проводящей системы, более устойчивы к гипоксии, чем сократительные кардиомиоциты и не всегда погибают в зоне ишемии. Вместе с тем электрофизиологические свойства таких ишемизированных волокон Пуркинье существенно отличаются от параметров интактных волокон. У них появляется пейсмекерная активность, а способность к проведению импульса существенно снижается. Кроме того, спонтанная биоэлектрическая активность, возникающая в этих волокнах, в условиях патологии не подавляться импульсами, поступающими из СА-узла, и может быть причиной возникновения желудочковых экстрасистол.
3. Постдеполяризаиия и триггерная активность.
Постдеполяризация - вторичные подпороговые деполяризации (рис. З.6.5.).
Ранняя постдеполяризация - это преждевременная деполяризация клеток миокарда и проводящей системы, которая появляется тогда, когда фаза реполяризации потенциала действия еще не завершена, потенциал мембраны еще не достиг потенциала покоя {во время 3 фазы ПД). Этот преждевременный ПД рассматривается как триггерный (наведенный), поскольку он обязан своим возникновением ранней постдеполяризации, исходящей от основного ПД. В свою очередь, второй (наведенный) ПД за счет своей ранней постдеполяризации может вызвать третий, тоже триггерный ПД, а третий ПД - четвертый триггерный ПД и т.д. Если источник триггерной активности находится в желудочках, то на ЭКГ подобный тип нарушений образования импульсов проявляется, как желудочковая экстрасистолия или полиморфная желудочковая тахикардия.
Возникновению ранних постдеполяризаций способствуют: гиперкатехоламинемия, гипокалиемия, ацидоз, ишемия. Часто подобный автоматизм является результатом при-
199
менения антиаритмических препаратов, блокирующих К+-каналы (соталол, хинидин и
др.).
Поздние (задержанные) постдеполяризации - это преждевременная деполяризация клеток миокарда и проводящей ткани, которая появляется сразу же после завершения фазы реполяризации. Возникают, как правило, после частичной гиперполяризации (следовые потенциалы). Если амплитуда постдеполяризации достигает КУД, возникает ПД и т.д. Подпороговые колебания мембранного потенциала, которые в норме могут присутствовать, но никогда себя не проявляют, при патологических состояниях, вызывающих Са2+~ перегрузку кардиомиоцитов, могут возрастать по амплитуде, достигая порога возбуждения.
Триггерная активность клеток сердца, связанная с задержанными постдеполяризациями, может возникнуть под действием сердечных гликозидов, катехоламинов, при инфаркте миокарда.
со
1
X
ф
«к
3
X X
ф
|
|
|
ранняя постдеполяризация |
|
о— |
пд |
у \м \ у \; ^ V |
|
50 |
|
|
|
АЛ |
|
|
Поздняя
постдеполяризация
I -50-
ф
2 -100-
АР
Рис. 3.6.5. Триггерная активность [по Лилли Л., 2003]. А - ранняя постдеполяризация (указана стрелкой) наблюдается еще до полной реполяризации потенциала действия (ПД). Частые повторные постдеполяризации (пунктирная кривая) могут генерировать частые потенциалы действия и приводить к возникновению тахикардии. Б - поздняя постдеполяризация (указана стрелкой) наблюдается сразу после полной реполяризации потенциала действия (ПД). Если поздняя постдеполяризация достигает величины порогового потенциала, то генерируется новый потенциал действия (пунктирная кривая).
Б) Механизмы нарушений проведения импульса.
1, Нарушение проводимости (блокады)
« Снижение потенциала покоя или макскимального диастолического потенциала (например, в зоне ишемии инфаркта миокарда) сопровождается замедлением нулевой фазы ПД, поскольку уровень ПП коррелирует с процентом открытых быстрых Ка+-каналов в мембране. При снижении ПП до 50 мВ (в норме 80-90 мВ) инактивируется около 50% Ма+-каналов и возбуждение (проведение) становится невозможным (блокада).
■ Декрементное (затухающее) проведение заключается в постепенном уменьшении амплитуды ПД по мере проведения возбуждения по поврежденному, но еще жизнеспособному, сердечному волокну. Декрементное проведение возникает, как пра-
200
вило, при значительном повреждении сердечной мышцы, например, при остром ИМ в области, непосредственно примыкающей к зоне некроза (в периинфарктной зоне), вероятно, под влиянием увеличения внеклеточной концентрации К+.
■ Неравномерное проведение - в параллельных волокнах скорость изменяется неравномерно, деполяризация происходит также асинхронно, и общая эффективностьстимула падает (частичная или полная блокада).
2. Повторный вход волны возбуждения (ге-еШгу) - явление, при котором импульс, совершающий движение по замкнутому кругу (петле, кольцу), возвращается к месту своего возникновения, совершая круговое движение.
Различают тасго ге-еШгу (макроре-ентри) и тгсго ге-еШгу (микроре-ентри). При таком делении учитывают размеры петли (круга), в которой осуществляется повторный вход (рис.3.6.6.).
Для формирования тасго ге-еп*гу с характерными для него свойствами требуются определенные условия:
наличие устойчивой замкнутой петли, длина ее зависит от анатомического периметра невозбудимого препятствия, вокруг которого движется импульс;
однонаправленная блокада проведения в одном из сегментов петли ге-епйу;
продолжительность распространения волны возбуждения должна быть короче времени, за которое импульс может преодолеть всю длину петли ге-епЬу. Благодаря этому перед фронтом распространяющегося по кругу импульса имеется участок ткани, вышедший из состояния рефрактерности и успевший восстановить свою возбудимость («окно возбудимости»).
Механизм тасго ге-еп1ху лежит, как полагают, "в основе трепетания предсердий. Петля тасго-ге-еЩгу возникает (рис. 3.6.7);
в функционирующих дополнительных проводящих путях при синдроме преждевременного возбуждения (например, при синдроме Ч\ПР^);
в АВ-соединении;
в миокарде, окружающем крупный участок невозбудимой ткани сердца (постинфарктный рубец, аневризма ЛЖ);
в миокарде предсердий.
