
- •Лабораторная работа № 1. Кондуктометрическое кислотно-основное титрование
- •Анализ смеси сильной и слабой кислоты методом кондуктометрического титрования.
- •Лабораторная работа № 2. Определение концентрации хлорид-иона методом прямой кондуктометрии
- •Лабораторная работа № 3. Потенциометрическое кислотно-основное титрование
- •Оборудование и реактивы:
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка экспериментальных данных
- •Лабораторная Работа № 4. Потенциометрическое титрование с ионоселективным электродом
- •Лабораторная работа № 5. Фотометрическое определение содержания железа
- •Оборудование и реактивы.
- •Выполнение работы
- •I. Приготовление рабочего раствора соли железа.
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 6. Фотометрическое определение концентрации железа (III) в присутствии никеля
- •I. Получение спектров поглощения
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы, содержащей соль железа и никеля
- •Лабораторная работа № 7. Фотометрическое определение цветности воды
- •Лабораторная работа № 8. Определение сульфат-иона турбидиметрическим методом
- •Оборудование и реактивы.
- •Выполнение работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 9. Фотометрическое определение содержания никеля в сточных водах
- •I. Приготовление рабочего раствора соли никеля
- •II. Получение градуировочной зависимости
- •III. Проведение анализа пробы
- •Лабораторная работа № 10. Разделение катионов меди и цинка методом ионообменной хроматографии
- •Выполнение работы
- •Содержание протокола лабораторной работы
- •Обработка результатов эксперимента
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 11. Определение концентрации катионов меди методом прямой потенциометрии
- •II. Получить градуировочную зависимость и измерить эдс пробы при помощи ионоселективного электрода.
Протокол лабораторной работы
Концентрация стандартного раствора соли железа:
Сст.(Fe3+) = ________________ г/л;
Объем стандартного раствора соли железа, использованный для приготовления рабочего раствора соли железа:
Vст.(Fe3+) = ________________ мл;
Объем приготовленного рабочего раствора соли железа (III):
Vраб. = ____________________ мл;
Объем пробы исследуемого раствора, взятый для анализа
Va = ______________________ мл;
Зависимость оптической плотности раствора от объема рабочего раствора соли железа
№ колбы |
2 |
3 |
4 |
5 |
6 |
7 |
VFe3+, мл |
2 |
4 |
6 |
8 |
10 |
проба |
DFe |
|
|
|
|
|
|
Обработка результатов эксперимента
1. Вычислить концентрацию рабочего раствора соли железа:
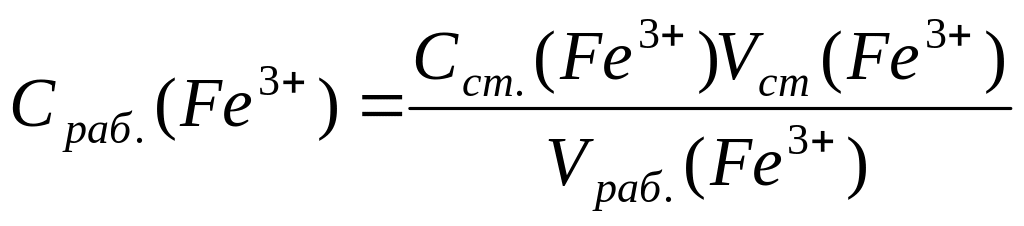 ,
г/л.
,
г/л.
2. По данным таблицы 2 заполнить таблицу:
Данные для построения градуировочной зависимости
№ колбы |
2 |
3 |
4 |
5 |
6 |
V(Fe3+), мл |
2 |
4 |
6 |
8 |
10 |
D(Fe) |
|
|
|
|
|
m(Fe), мг |
|
|
|
|
|
3. По данным таблицы 3 построить градуировочную зависимость в координатах D – m(Fe) (см. рис. 4).
4. По градуировочному графику определить массу железа в пробе (см. рис. 4).
5. Рассчитать концентрацию железа в пробе раствора:
![]() .
(10)
.
(10)
Лабораторная работа № 6. Фотометрическое определение концентрации железа (III) в присутствии никеля
Цель работы. Построение кривых светопоглощения, выбор оптимального участка длин волн и определение в растворе концентрации соли железа в присутствии соли никеля.
Сущность работы. Растворы солей никеля и тиоцианатного комплекса железа имеют различную окраску, что позволяет выделить участок спектра, где светопоглощение комплексом железа велико, а светопоглощение раствором соли никеля незначительно. При этой длине волны оптическая плотность раствора будет почти целиком определяться концентрацией железа. разность оптических плотностей раствора до прибавления роданида Dн и после его прибавления Dк (D = Dк – Dн ) пропорциональна концентрации железа. По известным значениям D для стандартных растворов строят калибровочный график в координатах D – концентрация железа (в мг/мл), а затем по величине D исследуемого раствора с помощью этого графика находят искомую концентрацию.
Оборудование и реактивы. Спектрофотометр или фотоколориметр; кюветы толщиной 1 см – 2 шт; колба мерная емкостью 200 мл – 1 шт.; колба мерная емкостью 100 мл – 2 шт.; колба мерная емкостью 50 мл – 8 шт.; стакан химический объемом 100 мл – 6 шт.; пипетка градуированная объемом 10 мл – 4 шт.; пипетка мерная объемом 5 мл – 1 шт.; стандартный раствор соли железа [(NH4)Fe(SO4)212H2O], содержащий 2 г/л железа (III); стандартный раствор соли никеля, содержащий 10 г/л никеля; тиоцианат (роданид) калия или аммония – 1 М раствор; соляная кислота – 2 н. раствор; пробы с исследуемым раствором.
Выполнение работы
