
Патофизиология. Литвицкий. 2013
.pdfадаптивных механизмов (защиты и регенерации повреждённых структур, компенсации нарушенных процессов в клетке).
ЛИЗИС И АУТОЛИЗ
Некротизированные клетки подвергаются деструкции (лизису)
при помощи лизосомных ферментов и свободных радикалов. Гидролиз внутриклеточных компонентов и межклеточного вещества происходит под влиянием ферментов лизосом альтерированных клеток.
Высвобождению лизосомных ферментов способствует развитие внутриклеточного ацидоза.
Деструкция повреждённых компонентов клеток осуществляется при участии активных форм кислорода и свободных радикалов. Факты интенсификации свободнорадикальных и липопероксидных реакций описаны при остром воспалении, механическом повреждении, на определённых этапах развития инфаркта (частной формы некроза,
развивающегося вследствие нарушения кровоснабжения ткани),
опухолевого роста (сопровождается гибелью большого числа как злокачественных, так и окружающих нормальных клеток) и других патологических процессах. Эти два механизма обеспечивают саморазрушение структур клетки (аутолиз).
Разрушение повреждённых и некротизированных клеток происходит и при участии других клеток – фагоцитов, а также микроорганизмов. В отличие от аутолитического распада, последний механизм обозначают как гетеролитический.
АПОПТОЗ
181
Апоптоз является еще одним – своеобразным вариантом гибели отдельных клеток.
АПОПТОЗ
•форма гибели отдельных клеток,
возникающая под действием внеили внутриклеточных факторов,
осуществляющаяся путём активации специализированных внутриклеточных процессов, регулируемых определёнными генами.
Апоптоз – это общебиоогическое явление, заключающееся в программируемой гибели клетки. В этом его принципиальное отличие от некроза.
Другое важное отличие апоптоза от некроза состоит в том, что программу апоптоза запускает информационный сигнал, тогда как некроз клеток развивается под непосредственным влиянием повреждающего агента.
В финале некроза происходит лизис клеток и освобождение их содержимого в межклеточное пространство. В связи с этим, в зоне некроза развивается воспаление. Апоптоз же завершается фагоцитозом фрагментов разрушенной клетки и признаки воспаления, как правило,
отсутствуют.
182
Некроз – всегда результат действия патогенного фактора значительной силы. Апоптоз, в отличие от этого, наблюдается в ходе многих физиологических процессов, а также при адаптации клетки к факторам среды.
Апоптоз – в отличие от некроза – энергозависим. Он требует синтеза РНК и белков.
ПРОЯВЛЕНИЯ АПОПТОЗА
При апоптозе цитоплазма клетки уплотняется, конденсируется хроматин, ядро подвергается пикнозу с последующим кариорексисом.
Фрагментации ядра предшествует межнуклеосомная упорядоченная деградация ядерной ДНК с образованием последовательно уменьшающихся фрагментов длиной до 180 пар оснований. Распад ДНК на отдельные нуклеосомные фрагменты с разрывами нуклеотидной цепочки приводит к появлению фрагментов ДНК разной длины.
В конечной стадии апоптоза фрагментации подвергаются сами клетки с формированием так называемых апоптозных телец – окружённых мембраной фрагментов клеток, включающих остатки органелл, цитолеммы, цитоплазмы, хроматина.
Клетки, вошедшие в апоптоз, и апоптозные тельца фагоцитируются макрофагами и гранулоцитами
ПРИМЕРЫ АПОПТОЗА
Запрограммированная гибель клеток. Это естественный процесс гибели клеток и элиминации целых их клонов в ходе эмбрионального развития, гистогенеза и морфогенеза органов. В
данном случае речь идёт о гибели клеток, не достигших состояния
183

терминальной дифференцировки. Примером служит запрограммированная гибель нейробластов (от 25 до 75%) на определённых этапах развития мозга.
Дегенерация. При некоторых патологических состояниях наблюдается избирательная гибель клеток, например, в нервной системе при боковом амиотрофическом склерозе (болезни Шарко) и болезни
Альцхаймера. Врождённая форма бокового амиотрофического склероза обусловлена мутацией гена Cu/Zn–супероксиддисмутазы 1. Продукт дефектного гена не способен ингибировать ИЛ1 -конвертирующий фермент. Образующийся при этом ИЛ1 воздействует на двигательные нейроны и вызывает их апоптоз.
Ликвидации аутоагрессивных T-клеток. Имеет место на определенных этапах развития тимуса, после завершеия иммунного ответа или устранения клеток, подвергшихся воздействию цитотоксических T-лимфоцитов.
Трансфекция. Внедрение в клетку нуклеиновой кислоты вируса
(например, при вирусном гепатите, миокардите, энцефалите, СПИДе)
нередко сопрвождается ее апоптозом.
Повреждение клетки. Воздействие на клетку агентов,
повреждающих её, но не приводящих к некрозу (например,
повышенной температуры, радиации, цитостатиков, гипоксии).
Увеличение же интенсивности этих воздействий приводит к некрозу.
Опухолевый рост. Апоптоз как правило выявляется и при формировании опухолевого узла и при его деструкции).
МЕХАНИЗМ АПОПТОЗА
184
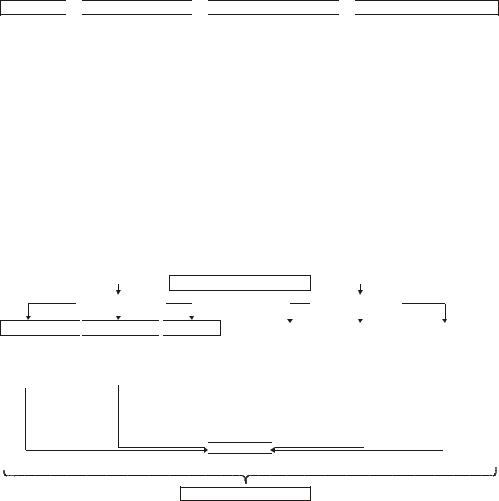
В процессе реализации апоптоза условно выделяют четыре
стадии (рис. 5–16).
Инициации 
 Программирования
Программирования
 Реализации программы
Реализации программы
 Удаление погибшей клетк
Удаление погибшей клетк
Рис. 5–16. Стадии апоптоза.
Стадия инициации
На этой стадии информационные сигналы рецептируются клеткой. Патогенный агент либо сам является сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам (рис. 5–17).
Агенты, инициирующие апоптоз
Трансмембранные |
|
|
|
Внутриклеточные |
||
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
“Отрицательные” 
 “Положительные”
“Положительные”
 Смешанные
Смешанные
Дефицит: |
Фактор некроза |
+Митоген -Аг |
Факторов роста |
опухолей |
+Аг -митоген |
Цитокинов |
Молекула |
… |
Гормонов |
CD95L |
|
... |
… |
|
|
Физико-химические |
|
Вирусы |
|
Гормоны, проникающие |
|
|
факторы |
|
|
|
|
в клетку |
|
|
|
|
|
|
|
Ацидоз |
Гепатотропные Глюкокортикоиды |
|||||
Избыток свободных |
||||||
радикалов |
Нейротропные |
Минералокортикоиды |
||||
|
|
|
|
Тиреоидные |
||
Повышенная |
… |
|
температура |
||
|
||
… |
|
 Геном клетки
Геном клетки 
Программа апоптоза
Рис. 5–17. Апоптоз: стадия инициации.
Инициирующие |
апоптоз |
стимулы |
могут |
быть |
трансмембранными или внутриклеточными. Трансмембранные
сигналы условно подразделяют на «отрицательные», «положительные»
185
и «смешанные». «Отрицательным» сигналом считается отсутствие или прекращение воздействия на клетку биологически необходимого фактора (например, фактора роста или цитокина, регулирующих деление и созревание клетки; гормона, контролирующего развитие клетки).
В норме действие названных выше групп БАВ на мембранные рецепторы обеспечивает подавление программы гибели клеток и нормальную их жизнедеятельность. Напротив, их отсутствие или уменьшение эффектов «освобождает» программу апоптоза. Так, для нормальной жизнедеятельности ряда нейронов необходимо постоянное наличие нейротрофических факторов. Их устранение или снижение эффектов на нервные клетки может привести к включению программы смерти нейрона. «Положительные» непосредственно запускают программу апоптоза. Так, связывание ФНО-α (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки.
«Смешанные» сигналы являются комбинацией воздействий сигналов первой и второй групп. Так, апоптозу подвергаются лимфоциты,
простимулированные митогеном, но не проконтактировавшие с чужеродным Аг. Погибают и те лимфоциты, на которые воздействовал Аг, но не получившие других сигналов, например, митогенного или от
HLA.
Среди внутриклеточных стимулов апоптоза наибольшее значение имеют избыток H+, свободных радикалов липидов и других веществ, повышенная температура, появление внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы
(например, глюкокортикоиды).
186

Стадия программирования
Стадия программирования (контроля и интеграции процессов
апоптоза) представлена на рис. 5–18).
|
|
|
|
|
|
|
|
|
Инициаторы (“стимуляторы”) апоптоза |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Прямая реализация |
|
|
|
|
Опосредованная реализация |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Адапторные белки |
|
Гранзимы |
|
Цитохром С |
|
|
|
Геном клетки |
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Экспрессия генов апоптоза: |
|
Репрессия “антиапоптозных” генов: |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Bad, Bax, Rb, p53 и др. |
|
|
|
|
Bcl, Bcl-XL и др. |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Белки-промоторы апоптоза |
|
|
Белки-ингибиторы апоптоза |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эффекторные каспазы |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Эндонуклеазы |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Реализация программы апоптоза
Рис. 5–18. Апоптоз: стадия программирования.
На этой стадии специализированные белки либо реализуют сигнал к апоптозу путём активации исполнительной программы (её эффекторами являются цистеиновые протеазы – каспазы и эндонуклеазы), либо блокируют потенциально летальный сигнал.
Выделяют два (не исключающих друг друга) варианта реализации стадии программирования: 1. Путём прямой активации эффекторных каспаз и эндонуклеаз (минуя геном клетки) и
2. Опосредованной их активации через экспресию определенных генов.
Прямая передача сигнала осуществляется через адапторные белки, гранзимы и цитохром С В качестве адапторного белка
выступает, например, каспаза–8. Так реализуют своё действие цитокины
187
T-лимфоцитов–киллеров в отношении чужеродных клеток, ФНО и другие лиганды CD95. Цитохром C, выделяясь из митохондрий, вместе с белком Apaf–1 и каспазой–9 формирует комплекс активации
(апоптосому) эффекторных каспаз. Каспаза–8 и каспаза–9 активируют эффекторные каспазы (например, каспазу–3), которые участвуют в протеолизе белков. Гранзимы, представляющие собой протеазы,
выделяются цитотоксическими T-лимфоцитами. Протеазы могут проникать в клетки-мишени через цитоплазматические поры,
предварительно сформированные перфоринами. Гранзимы активируют аспартатспецифические цистеиновые протеазы клетки-мишени,
подвергающейся апоптозу. Прямая передача сигнала наблюдается обычно в безъядерных клетках, например, эритроцитах.
Опосредованная передача сигнала подразумевает репрессию генов, кодирующих ингибиторы апоптоза и экспрессию генов,
кодирующих промоторы апоптоза. Белки-ингибиторы апоптоза
(например, продукты экспрессии антиапоптозных генов Bcl–2, Bcl-XL)
блокируют апоптоз (например, путём уменьшения проницаемости мембран митохондрий, тем самым уменьшая вероятность выхода в цитозоль одного из пусковых факторов апоптоза — цитохрома C).
Белки-промоторы апоптоза (например, белки, синтез которых контролируется генами Bad, Bax, антионкогенами Rb или p53)
активируют эффекторные каспазы и эндонуклеазы.
Стадия реализации программы
Стадия реализации программы апоптоза (исполнительная,
эффекторная) состоит в собственно гибели клетки, осуществляемой посредством активации протеаз и эндонуклеаз (рис. 5–19).
188

|
|
|
|
|
Инициаторы апоптоза |
|
|
|
|
|
|
Регуляторы апоптоза |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эффекторные каспазы |
|
|
|
|
|
|
|
|
Эндонуклеазы |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Деструкция белков |
|
|
Разрушение структурных |
|
Деструкция регуляторных |
|
Фрагментация ДНК |
|
||||||||||||
цитоскелета |
|
|
|
белков ядра |
|
|
|
белков ядра |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Разрушение клетки Образование апоптозных телец
Фагоцитоз погибшей клетки и её фрагментов
Рис. 5–19. Апоптоз: стадия реализации программы.
Непосредственными исполнителями процесса «умертвления» клетки являются Ca2+,Mg2+-зависимые эндонуклеазы (катализируют распад нуклеиновых кислот) и эффекторные каспазы (подвергают протеолитическому расщеплению различные белки, в том числе белки цитоскелета, ядра, регуляторные белки и ферменты). В результате разрушения белков и хроматина в процессе апоптоза клетка подвергается деструкции. В ней формируются и от неё отпочковываются фрагменты, содержащие остатки органелл,
цитоплазмы, хроматина и цитолеммы — апоптозные тельца.
Стадия удаления фрагментов погибших клеток
На поверхности апоптозных телец экспрессируются лиганды, с
которыми взаимодействуют рецепторы фагоцитирующих клеток.
Фагоциты обнаруживают, поглощают и разрушают апоптозные тельца.
Благодаря этому, содержимое разрушенной клетки практически не попадает в межклеточное пространство, а при апоптозе как правило
189

отсутствует воспалительная реакция. Этот признак отличает апоптоз от
некроза, который сопровождается развитием перинекротического
воспаления.
ПРОЯВЛЕНИЯ ПОВРЕЖДЕНИЙ КЛЕТОК
Любое повреждение клетки вызывает в ней разной степени
выраженности специфические и неспецифические изменения (рис. 5–
20).
Действие патогенных факторов
Повреждение клетки
Проявления повреждения клетки
|
Специфические |
|
Неспецифические |
* Свойственны для: |
* Свойственны для: |
||
-данной (определённой) клетки; - разных факторов, повреждающих клетки;
-данного (определённого) фактора. - различных типов повреждённых клеток.
Рис. 5–20. Проявления повреждения клетки.
СПЕЦИФИЧЕСКИЕ ИЗМЕНЕНИЯ КЛЕТОК ПРИ ПОВРЕЖДЕНИИ
Специфические изменения клеток при повреждении
характерны для данного патогенного фактора при действии его на
различные клетки. Так, повышение осмотического давления в клетке сопровождается её гипергидратацией, растяжением мембран и нарушением их целостности; разобщители окисления и фосфорилирования (например, высшие жирные кислоты — ВЖК, Ca2+)
снижают или блокируют сопряжение этих процессов и уменьшают
190
