
Патофизиология. Литвицкий. 2013
.pdfэнергетического обеспечения селективного переноса катионов,
расстройства работы ионообменных механизмов (Н+-Ca2+, Na+-Ca2+, H+-K+), снижение кинетической активности катион-зависимых мембранных АТФаз (Na+,K+-АТФазы, Ca2+,Mg2+-АТФазы), нарушения физико-химического состояния и микроструктуры клеточных мембран.
Последнее проявляется фазным увеличением или снижением степени
«жёсткости», а следовательно, и проницаемости мембран для ионов;
дефектами цитоскелета (микрофиламенты, микротрубочки,
промежуточные нити, связанные со структурными элементами клеточных мембран); образованием микроразрывов (микробрешей,
простейших транспортных каналов) в плазмолемме и мембранах клеточных органелл.
В совокупности эти изменения сопровождаются потерей клетками K+, Mg2+, ряда микроэлементов и увеличением их концентрации на внешней поверхности клеточной мембраны.
Одновременно с этим повышается внутриклеточное содержание Na+ и Ca2+, а также воды.
Проявляется дисбаланс ионов и жидкости нарушениями распределения ионов по обе стороны плазмолеммы. При этом обычно наблюдается потеря клеткой K+, Mg2+, микроэлементов и накопление их в межклеточной жидкости. В клетку же поступают ионы Na+, Ca2+ и
некоторые другие; изменениями соотношения отдельных ионов как в клетке, так и вне ее в результате расстройства механизмов трансмембранного переноса ионов; гипергидратацией ткани в очаге воспаления в связи с высокой гидрофильностью накапливающихся в нём Na+ и Ca2+, а также продуктов гидролиза органических соединений;
высвобождением дополнительного количества катионов (K+, Na+, Ca2+,
231
железа, цинка) при гидролизе солей, распаде гликогена, белков и других органических соединений, а также — клеточных мембран; выходом большого количества Ca2+ из повреждённых внутриклеточных депо
(например, митохондрий и цистерн эндоплазматической сети и митохондрий).
Основными последствиями дисбаланса ионов и жидкости в
очаге воспаления являются: – значительное увеличение осмотического давления внутри клеток, набухание их и их органелл, перерастяжение и разрыв мембран и в конце концов – гибель клеток; – расстройства формирования МП и ПД, стойкая деполяризация мембран возбудимых клеток (в особенности кардиомиоцитов), сочетающаяся со снижением их функций и болевой чувствительности в центре очага воспаления (в
зоне первичной альтерации).
Названные выше механизмы дисбаланса ионов и воды в очаге воспаления действуют не только на клетки организма, но и на флогогенный фактор, что может привести и к его повреждению.
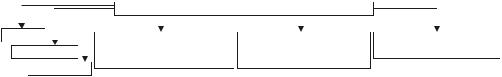
Расстройства обмена веществ сопровождаются существенными и закономерными физико-химическими сдвигами в очаге воспаления.
ФИЗИКО-ХИМИЧЕСКИЕ ИЗМЕНЕНИЯ
Основные физико-химические изменения в очаге воспаления
приведены на рис. 6–6.
|
|
|
|
Физико-химические изменения в очаге воспаления |
|
|
|||
|
|
|
|
|
|
|
|
|
|
Ацидоз |
|
|
Изменение поверхностного |
Снижение поверхностного |
Изменение коллоидного |
||||
|
|
|
|
||||||
Гиперосмия |
|
заряда и электрических |
натяжения мембран |
состояния цитоплазмы |
|||||
|
Гиперонкия |
потенциалов клетки |
клеток |
|
|
||||
|
|
|
|
|
|
|
|||
232
Рис. 6–6. Физико-химические изменения в очаге воспаления.
АЦИДОЗ |
|
Воспаление |
характеризуется увеличением [Н+] и, |
соответственно, снижением рН в клетках и межклеточной жидкости – развитием ацидоза.
Причина
Причина метаболического ацидоза – накопление в очаге воспаления избытка недоокисленных соединений.
Механизмы накопления «кислых» метаболитов различны.
Они заключаются в образовании большого количества продуктов изменённого метаболизма вследствие: – активации гликолиза, что сопровождается накоплением молочной и пировиноградной кислот; –
усиления протеолиза и липолиза с образованием аминокислот, ВЖК и кетоновых тел; – нарушения оттока от очага воспаления продуктов как нормального, так и нарушенного обмена веществ. Последнее особенно выражено в связи с замедлением оттока венозной крови и развитием стаза в очаге воспаления; –«истощения» щелочных буферных систем
(бикарбонатной, фосфатной, белковой и других) клеток и межклеточной жидкости, которые на начальном этапе воспаления нейтрализуют избыток кислых соединений.
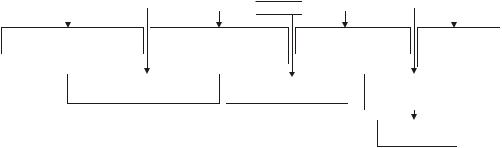
Последствия ацидоза
Последствия метаболического ацидоза в очаге воспаления приведены на рис. 6–7.
233

 Ацидоз
Ацидоз 

Повышение проницаемости |
Увеличение проницаемости |
Активация ферментов |
Формирование |
|||
стенок сосудов отёк |
мембран |
лизосом |
ощущения |
|||
|
клеток их набухание |
|
|
боли |
||
Усиление гидролиза белковых |
Усиление гидролиза |
Изменение |
||||
чувствительности |
||||||
мицелл гиперонкия |
веществ гиперосмия |
|||||
к БАВ |
||||||
|
|
|
|
|||
Изменение эффектов БАВ
Рис. 6–7. Эффекты ацидоза в очаге воспаления.
ГИПЕРОСМИЯ
В очаге воспаления закономерно, в большей или меньшей мере,
повышается осмотическое давление.
Причинами гиперосмии являются: – повышенное ферментативное и неферментное разрушение макромолекул (гликогена,
гликозаминогликанов, протеогликанов и других); – усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества; – поступление осмотически активных соединений из повреждённых и разрушенных клеток.
Гиперосмия обусловливает: –гипергидратацию в очаге воспаления; – повышение проницаемости сосудистых стенок; –
стимуляцию эмиграции в зону воспаления лейкоцитов; – изменение тонуса стенок сосудов и кровообращения ; – формирование чувства боли.
ГИПЕРОНКИЯ
Увеличение онкотического давления в воспалённой ткани – закономерный феномен.
234
Причинами гиперонкии являются: – увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов; – повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействия с ионами; – выход белков (в основном — альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов.
Основное последствие гиперонкии в очаге воспаления это
развитие отёка.
ПОВЕРХНОСТНЫЙ ЗАРЯД И ЭЛЕКТРИЧЕСКИЕ ПОТЕНЦИАЛЫ КЛЕТОК
Альтерация тканей при воспалении ведёт к изменению (как правило —снижению) их поверхностного заряда, а также – мембранных потенциалов возбудимых клеток.
Причины нарушений заряда и потенциалов мембран клеток: –
повреждение клеточных мембран, – расстройства энергообеспечения трансмембранного переноса ионов, – ионный баланс во внеклеточной жидкости.
Основные последствия отклонения мембранных потенциалов клеток в очаге воспаления: – изменения порога возбудимости клеток; –
колебание чувствительности клеток к действию БАВ (цитокинов,
гормонов, нейромедиаторов и других); – потенцирование миграции фагоцитов за счёт электрокинеза (см. рис. 6–20); – стимуляция кооперации клеток в связи со снижением величины отрицательного поверхностного их заряда, нейтрализацией его или даже перезарядкой
(у повреждённых и погибших клеток внешняя поверхность цитолеммы
235
заряжена положительно в связи с избытком на ней К+, Н+ и др.
катионов).
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ МЕМБРАН КЛЕТОК
Для очага воспаления характерно уменьшение поверхностного натяжения клеточных мембран.
Основная причина этого – значительное увеличение концентрации в очаге воспаления поверхностноактивных веществ
(фосфолипидов, ВЖК, K+, Ca2+ и некоторых других).
Основными последствиями уменьшения поверхностного натяжения клеточных мембран при воспалении являются: – облегчение подвижности лейкоцитов (уменьшение поверхностного натяжения плазмолеммы способствует образованию псевдоподий); –
потенцирование процесса адгезии фагоцитов к объекту фагоцитоза; –
облегчение контакта фагоцитов и лимфоцитов при развитии реакций иммунитета и аллергии.
КОЛЛОИДНОЕ СОСТОЯНИЕ ЦИТОЗОЛЯ И МЕЖКЛЕТОЧНОГО ВЕЩЕСТВА
Изменения коллоидного состояния цитозоля и межклеточного вещества выявляются уже на начальном этапе воспаления.
Причина этого – накопление избытка Н+, K+, Na+, жирных кислот, пептидов, аминокислот, других метаболитов и БАВ (наряду с изменением степени гидратации цитоплазмы) приводит к облегчению переходов цитозоля: «гель – золь». В наибольшей степени такая трансформация характерна для фагоцитов.
Основные механизмы изменения коллоидного состояния в
очаге воспаления: – колебание степени полимеризации макромолекул
236

(гликозаминогликанов, белков, протеогликанов и других); – фазовые переходы состояния микрофиламентов интерстиция. Переход цитозоля в состояние геля происходит при образовании из нитей F–актина упорядоченной структуры (актиновая решётка). Такая структура формируется при перекрестном соединении нитей актина с участием актинсвязывающих белков и при низкой концентрации Ca2+. При увеличении в цитозоле содержания Ca2+ процесс формирования актиновой решётки подавляется, цитоплазма приобретает состояние золя.
Главные последствия изменений коллоидного состояния цитозоля и интерстиция заключается в: – изменении тканевой проницаемости (в основном –стенок микрососудов) и – потенцировании процесса миграции лейкоцитов к объекту фагоцитоза.
МЕДИАТОРЫ ВОСПАЛЕНИЯ
Образование и реализация эффектов БАВ – одно из ключевых звеньев воспаления. БАВ обеспечивают закономерный характер развития воспаления, формирование его общих и местных проявлений,
а также исходы воспаления. Именно поэтому БАВ нередко именуют как
«пусковые факторы», «организаторы», «внутренний двигатель», «мотор» воспалительной реакции, «медиаторы воспаления».
МЕДИАТОРЫ ВОСПАЛЕНИЯ —
•БАВ, образующиеся при воспалении,
•обеспечивающие закономерный характер его развития и исходов,
237
• формирование его местных и общих признаков
Все медиаторы воспаления и их неактивные предшественники образуются в клетках организма. Но их подразделяют на клеточные и плазменные (рис. 6–8).
 Медиаторы воспаления
Медиаторы воспаления 
 Клеточные
Клеточные 
*Синтезируются в клетках;
*Высвобождаются в очаге воспаления; как правило, в активированном состоянии
 Плазменные
Плазменные 
*Синтезируются в клетках;
*Высвобождаются в плазму крови и/или межклеточную жидкость в неактивном состоянии;
*Активируются непосредственно в очаге воспаления
Рис. 6–8. Виды медиаторов воспаления.
Клеточные медиаторы высвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в
которых они синтезировались и накопились.
Плазменные медиаторы образуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но в не активном состоянии,
а в виде предшественников. Эти вещества активируются под действием различных промоторов преимущественно в плазме крови.
Они становятся физиологически дееспособными и поступают в ткани.
Предложено несколько классификаций групп медиаторов воспаления. Все они содержат в качестве классифицирующих несколько критериев. Рассматриваемые далее медиаторы воспаления подразделены на группы и подгруппы в соответствии со сложившимся
238
на момент написания учебника представлениями. Некоторые пояснения приводятся в тексте этого раздела, а также в статьях «Цитокины», «Хемокины», «Факторы», «Интерлейкины», «Интерфероны», «Лейкоциты», «Макрофаги», «Тромбоциты» (см. «Справочник терминов» на компакт-диске).
КЛЕТОЧНЫЕ МЕДИАТОРЫ ВОСПАЛЕНИЯ
Основные группы клеточных медиаторов воспаления приведены на рис. 6–9.
 Медиаторы воспаления: клеточные
Медиаторы воспаления: клеточные

Биогенные амины: |
Производные жирных |
Нейромедиаторы:: |
Пептиды |
Нуклеотиды и нуклеозиды: |
||||||
* гистамин |
кислот и липиды: |
* норадреналин |
и белки: |
* адениннуклеозиды |
||||||
* серотонин |
* простагландины |
* адреналин |
*лейкокины |
* циклические нуклеотиды |
||||||
|
|
* лейкотриены |
* ацетилхолин. |
* цитокины |
* свободные нуклеотиды |
|||||
|
|
* липопероксиды |
Нейропептиды |
*ферменты |
|
|
|
|||
|
|
|
|
|
|
|
|
Оксид азота |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Закономерная динамика процесса воспаления, формирование его местных и общих признаков |
||||||||||
Рис. 6–9. Основные классы клеточных медиаторов
воспаления.
БИОГЕННЫЕ АМИНЫ
Из биогенных аминов наиболее значимую роль при воспалении играют гистамин, серотонин, адреналин и норадреналин.
Гистамин. Основными источниками гистамина являются базофилы и тучные клетки. Действие гистамина опосредуют H1- и H2-рецепторы на клетках-мишенях. H1-рецепторы активируются малыми дозами гистамина. Эффектами их активации являются ощущения боли, жжения, зуда, напряжения. Н2-рецепторы
239
активируются гистамином в высокой его концентрации. Эффекты их возбуждения заключаются в изменении синтеза Пг, потенцировании образования циклических нуклеотидов, повышении проницаемости стенок микрососудов и (особенно – венул), активации миграции макрофагов, нейтрофилов, эозинофилов в очаг воспаления, сокращении ГМК. Промежуточные дозы гистамина активируют оба вида
рецепторов. Это сопровождается значительным расширением артериол и развитием в очаге воспаления артериальной гиперемии, снижением порога возбудимости и повышением чувствительности тканей, в том числе –болевой.
Серотонин. Источниками серотонина являются тромбоциты,
тучные клетки, нейроны, энтероэндокринные клетки. К числу основных эффектов серотонина в очаге воспаления относят
повышение проницаемости стенок микрососудов, активацию
сокращения ГМК венул (что способствует развитию венозной гиперемии), формирование чувства боли, активацию процессы
тромбообразования.
Адреналин и норадреналин. Эффекты норадреналина в очаге воспаления являются в основном результатом его действия на клетки как нейромедиатора симпатической нервной системы (его прямые метаболические эффекты – в отличие от адреналина – сравнительно мало выражены).
НЕЙРОМЕДИАТОРЫ
Из нейромедиаторов при развитии воспалении наиболее важную роль играют катехоловые амины и ацетилхолин.
240
