
- •Лабораторный практикум по химии Учебное пособие
- •Владивосток
- •Химические элементы
- •Простые вещества
- •Кислоты
- •Лабораторная работа № 1 классы неорганических соединений
- •Кислоты
- •Генетическая связь между классами неорганических соединений
- •Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа № 2 определение молярной массы эквивалента металла
- •Экспериментальная часть
- •Упругость водяных паров
- •Лабораторная работа № 3 комплексные соединения
- •Лабораторная работа № 4 кинетика химических реакций
- •Лабораторная работа № 5 определение концентрации растворов
- •Контрольные вопросы
- •Лабораторная работа № 6
- •Контрольные вопросы
- •Лабораторная работа № 7
- •Контрольные вопросы
- •Лабораторная работа № 8 окислительно-восстановительные процессы
- •Лабораторная работа № 9
- •Лабораторная работа № 10
- •Лабораторная работа № 11
- •Опыт 4. Коррозия в результате неравномерного доступа кислорода.
- •Контрольные вопросы
- •Лабораторная работа № 12
- •Экспериментальная часть
- •Лабораторная работа № 13
- •Характеристика отдельных полимеров
- •Контрольные вопросы
- •Приложение
- •Растворимость солей и оснований в воде
- •Содержание
Контрольные вопросы
1. Понятие о простых и сложных веществах; органических и неорганических соединениях; классах неорганических соединений.
2. Определение оксидов. Свойства оксидов. Какими свойствами обладают следующие оксиды: BaO, ZnO, MgO, Al2O3, CO2, P2O5, K2O, SO3, FeO, Fe2O3?
3. Определение оснований. Свойства оснований. Какими свойствами обладают следующие основания: KOH, Zn(OH)2, Fe(OH)2, Fe(OH)3, Ba(OH)2, Al(OH)3?
4. Определение кислот. Примеры кислот-неокислителей и кислот-окислителей.
5. Отношение соляной кислоты к металлам (Fe, Al, Mg, Ag, Hg, Ni).
6. Отношение азотной кислоты к металлам (Zn, Cu, Ag, Mg, Cr).
7. Определение солей. Средние, кислые, основные соли (примеры).
8. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
а) ![]() ;
;
б) 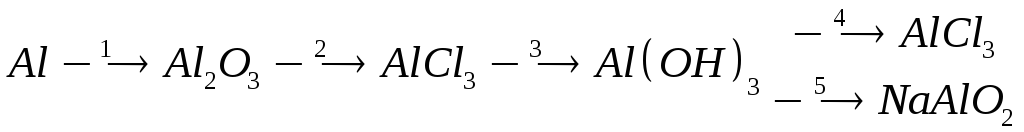 .
.
Лабораторная работа № 2 определение молярной массы эквивалента металла
Цель работы: определение молярной массы эквивалента металла по объему водорода, вытесненного из кислоты металлом, масса которого известна.
Эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Так же, как молекула, атом или ион, эквивалент безразмерен.
Для правильной записи химической формулы эквивалента вещества и определения его состава необходимо рассматривать конкретную реакцию, в которой участвует данное вещество.
Рассмотрим примеры определения формулы эквивалентов веществ:
а) окислительно-восстановительная реакция
![]() + 2HCl
= ZnCl
+ 2HCl
= ZnCl![]() + H
+ H![]() .
.
Β
данной окислительно-восстановительной
реакции одному электрону соответствует
1/2 атома Zn,
одна молекула HCl,
1/2 молекулы ZnCl2
и 1/2 молекулы H2.
Отсюда Э(Zn)=1/2Zn,
Э(HCl)=HCl,
Э(ZnCl2)=1/2ZnCl![]() ,
Э(H2)=1/2H2;
,
Э(H2)=1/2H2;
б) ионо-обменная реакция
![]() .
.
Β данной ионообменной реакции участвуют два иона водорода. На один ион водорода приходится:
![]() .
.
Поэтому
Э(NaOH)
=
NaOH,
Э(![]() )=1/2
)=1/2![]() ,
Э(
,
Э(![]() )=
)=![]() ,
Э(
,
Э(![]() )=1/2
)=1/2![]() .
.
Единицей количества вещества является моль. Массу одного моля эквивалентов называют молярной массой эквивалентов вещества (МЭ).
Например, молярные массы эквивалентов веществ в рассмотренных реакциях равны:
Mэ(Zn) = 1/2M(Zn) = 1/265 = 32,5 г/моль,
Mэ(HCl) = 1/2M(HCl) = 36,5 г/моль.
Для расчета молярной массы эквивалентов вещества можно использовать формулы:
а)
для простого вещества Mэ
=
![]() ,
(1)
,
(1)
где
![]() –молярная
масса атома данного вещества, Β
– валентность атома;
–молярная
масса атома данного вещества, Β
– валентность атома;
б)
для сложного вещества Mэ
=
![]() , (2)
, (2)
где М – молярная масса данного вещества, Β – валентность функциональной группы, n – число функциональных групп в молекуле.
Для кислот функциональной группой является ион водорода, для основания – ион гидроксила, для солей – ион металла.
Например,
Mэ(Al)
=
![]() =
=![]() = 9 г/моль;
= 9 г/моль;
Mэ(H2SO4)
=
![]() г/моль;
г/моль;
Mэ(Al2(SO4)3)
![]() г/моль.
г/моль.
Объем одного моля эквивалента газа можно рассчитать, исходя из того, что, согласно закону Авогадро, моль любого газа при нормальных условиях занимает объем, равный 22,4 л.
Например, для водорода: Э(H2) = 1/2H2, моль эквивалентов водорода в два раза меньше его моля молекул и поэтому объем одного моля эквивалентов водорода также в два раза меньше его молярного объема, то есть 22,4 л : 2 =11,2 л.
Для кислорода: Э(O2) = 1/4O2, отсюда объем одного моля эквивалентов кислорода в четыре раза меньше его молярного объема, то есть 22,4 л : 4 = 5,6 л.
Согласно закону эквивалентов массы участвующих в реакциях веществ пропорциональны молярным массам их эквивалентов:
 , (3)
, (3)
где m1 и m2 – массы веществ; МЭ1 и МЭ2 – молярные массы эквивалентов этих веществ.
Химические эквиваленты элементов определяют:
– экспериментально, по объему водорода, вытесненному определенным количеством металла из водородного соединения:
 ,
,
где m1 – масса взятого металла, г,
m2 – масса вытесненного водорода, г,
МЭ (Ме) – молярная масса эквивалента металла;
– по результатам химического анализа какого-нибудь соединения данного элемента с водородом, кислородом или другим элементом, эквивалент которого известен.
