
- •Министерство образования Российской Федерации
- •Титриметрический (объемный) анализ. Основные понятия
- •Лабораторная работа № 1 Определение содержания Na2co3 и NaHco3 при их совместном присутствии
- •Лабораторная работа № 2 Определение содержания NaОн и Na2co3 при их совместном присутствии
- •Лабораторная работа № 3 Перманганатометрия
- •Определение содержание железа (II)
- •Лабораторная работа № 4 Дихроматометрия
- •Определение содержания железа (II)
- •Лабораторная работа № 5 Иодометрия
- •Определение содержания меди (II)
- •Лабораторная работа № 6 Иодиметрия
- •Определение содержания формальдегида
- •Лабораторная работа № 7 Бромометрия
- •Лабораторная работа № 8 Комплексонометрическое титрование
- •Определение содержания кальция и магния при их совместном присутствии
- •Лабораторная работа № 9 Гравиметрический метод
- •Метод осаждения
- •Определение содержания сульфат-иона
- •Вопросы к коллоквиуму № 1
- •Вопросы к коллоквиуму № 2
- •1. Комплексонометрическое титрование
- •2. Гравиметрический анализ
- •Формулы для вычисления концентрации ионов водорода и значения рН водных растворов кислот, оснований и солей
- •Формулы для вычисления концентрации ионов водорода или гидроксила в разбавленных растворах (без учета ионной силы раствора)
- •Окислительно-восстановительные индикаторы
- •Нормальные окислительно-восстановительные потенциалы (Ео) по отношению к нормальному водородному электроду
- •Численные значения коэффициента Стьюдента
Министерство образования Российской Федерации
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
НЕФТИ И ГАЗА им. И.М. ГУБКИНА
ЗАВОРОТНЫЙ В.Л., КАЛАЧЕВА Н.А.
МЕТОДИЧЕСКОЕ РУКОВОДСТВО
К ЛАБОРАТОРНЫМ РАБОТАМ
ПО АНАЛИТИЧЕСКОЙ ХИМИИ
Tитриметрический анализ
(для студентов факультета химической технологии и экологии)
МОСКВА 2007
УДК 543
Заворотный В.Л., Калачева Н.А. Методическое руководство к лабораторным работам по аналитической химии. Титриметрический анализ. -М.:РГУ нефти и газа им. И.М. Губкина, 2007, - 44 с.
Методическое руководство к лабораторным работам содержит краткий теоретический материал по курсу «Аналитическая химия», 9 лабораторных работ по количественному анализу, закрепляющих практические навыки студентов по основным темам курса, а также справочный материал, необходимый для решения задач и обработки результатов анализа, оценки правильности и воспроизводимости полученных результатов. Методическое руководство по аналитической химии предназначено для бакалавров и студентов второго курса всех специальностей факультета химической технологии и экологии и соответствует учебной программе курса «Аналитическая химия».
Рецензент ‑ Е.М. Рудык, доцент кафедры общей и неорганической химии РГУ нефти и газа им. И.М. Губкина.
Предисловие
Методическое руководство составлено в соответствии с программой курса «Аналитическая химия, титриметрический анализ» для студентов специальностей 240401, 240403 и 280201 факультета химической технологии и экологии (лаборатория аналитической химии) и является дополнением к курсу лекций и дополнительной литературе, рекомендованной к программе по аналитической химии.
Методическое руководство создано с использованием материалов пособий А.В. Васильева «Количественный анализ» и Ю.В. Харитонова «Аналитическая Химия». В него добавлены новые лабораторные работы, краткий теоретический материал по темам лабораторных работ, внесены коррективы в список используемых реактивов и в редакцию ряда работ, а также справочный материал и примеры задач по разделу концентрация растворов.
Титриметрический (объемный) анализ. Основные понятия
Титриметрический, или объемный, анализ — метод количественного анализа, основанный на измерении объема (или массы) реагента Т, затраченного на реакцию с определяемым веществом X. Другими словами, титриметрический анализ — это анализ, основанный на титровании.
Титрование — процесс определения вещества Х постепенным прибавлением небольших количеств вещества Т, при котором каким-нибудь способом обеспечивают обнаружение точки (момента), когда все вещество Х прореагировало. Титрование позволяет найти количество вещества Х по известному количеству вещества Т, прибавленного до этой точки (момента), с учетом того, что соотношение, в котором реагируют Х и Т, известно из стехиометрии или как-то иначе.
Титрант — раствор, содержащий активный реагент Т, с помощью которого проводят титрование.
Обычно титрование проводят, прибавляя титрант из калиброванной бюретки в колбу для титрования с анализируемым раствором. В эту колбу перед титрованием вносят аликвотную долю анализируемого раствора.
Аликвотная доля (аликвота) — это точно известная часть анализируемого раствора, взятая для анализа. Часто она отбирается калиброванной пипеткой и ее объем обычно обозначается символом Vп.
Точка эквивалентности (ТЭ) — такая точка (момент) титрования, в которой количество прибавленного титранта Т эквивалентно количеству титруемого вещества X. Синонимы ТЭ: стехиометрическая точка, теоретическая конечная точка.
Конечная точка титрования (KТT) —точка (момент) титрования, в которой некоторое свойство раствора (например, его окраска) оказывает заметное (резкое) изменение. КТТ соответствует более или менее ТЭ, но чаше всего не совпадает с ней.
Индикатор — вещество, которое проявляет видимое изменение в ТЭ или вблизи ее. В идеальном случае индикатор присутствует в достаточно малой концентрации, чтобы в интервале его перехода не затрачивалось существенное количество титранта Т. Резкое видимое изменение индикатора (например, его окраски) соответствует КТТ.
Интервал перехода индикатора — область концентрации ионов водорода, металла или других ионов, в пределах которой глаз способен обнаружить изменение в оттенке, интенсивности окраски, флуоресценции или другого свойства визуального индикатора, вызванное изменением соотношения двух соответствующих форм индикатора. Эту область обычно выражают в виде отрицательного логарифма концентрации (например, рН = lg с(Н3О+)). Для окислительно-восстановительного индикатора интервал перехода представляет собой соответствующую область окислительно-восстановительного потенциала.
Кривая титрования — графическое изображение зависимости изменения концентрации с(Х) определяемого вещества Х или некоторого связанного с ним свойства системы (раствора) от объема V(Т) прибавленного титранта Т. Величина с(Х) в ходе титрования изменяется на несколько порядков, поэтому кривая титрования часто строится в координатах lgc(X) ‑ V(T) или рН -V(Т).
По оси абсцисс откладывают объем прибавляемого титранта V(Т).
Если по оси ординат откладывать равновесную концентрацию с(Х) или интенсивность пропорционального ей свойства, то получают линейную кривую титрования.
Если по оси ординат откладывать lg с(Х) или логарифм интенсивности свойства, пропорционального с(Х), то получают логарифмическую (или монологарифмическую) кривую титрования.
Для более четкого выявления особенностей процесса титрования и в прикладных целях иногда строят дифференциальные кривые титрования, откладывая по оси абсцисс объем прибавляемого титранта V(T), а по оси ординат — первую производную от логарифма концентрации (или интенсивности пропорционального ей свойства) по объему прибавляемого титранта dlgc(X)/d V(X). Такие кривые титрования обычно используют в физико-химических методах анализа, например при потенциометрическом титровании.
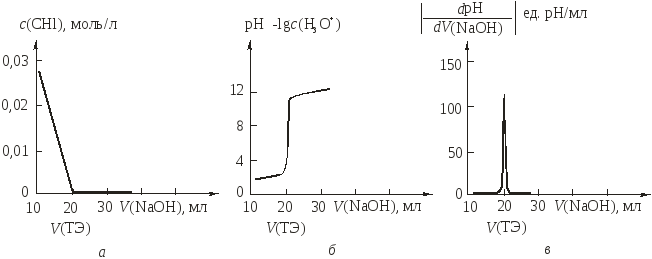 Рис.
1.Различные типы расчетных кривых
титрования 20мл
0,1моль/л раствора НС1 эквимолярным
растворомNaOH:
Рис.
1.Различные типы расчетных кривых
титрования 20мл
0,1моль/л раствора НС1 эквимолярным
растворомNaOH:
а —линейная кривая титрования; б —логарифмическая кривая титрования; в —дифференциальная кривая титрования
На линейных кривых титрования изменение концентрации титруемого вещества или титранта в ТЭ проявляется в форме более или менее четкого излома (рис. 1, а). При постепенном прибавлении титранта. концентрация титруемого вещества уменьшается, что соответствует левой части графика на рис. 1,а. В ТЭ титруемое вещество прореагировало с титрантом полностью, концентрация его практически равна нулю и при дальнейшем прибавлении титранта остается такой же — правая часть графика на рис. 1а совпадает с осью абсцисс. Однако вследствие большого изменения концентрации (на несколько порядков) вблизи ТЭ очень точное определение самой ТЭ и интервала перехода становится затруднительным. Поэтому при применении визуальных индикаторов линейные кривые титрования используют сравнительно редко.
Изменение концентрации в ТЭ на логарифмических кривые титрования (рис. 1б) проявляется (при определенных условиях) четко, в форме скачка. Поэтому логарифмические кривые титрования обычно используют для определения ТЭ и интервала перехода (скачка титрования).
На дифференциальных кривых титрования (рис. 1в) положение ТЭ соответствует максимуму кривой и поэтому определяется достаточно надежно.
Иногда строят билогарифметические кривые титрования, откладывая по оси ординат не логарифм концентрации, а логарифм отношения концентраций сопряженной пары веществ.
Используют также кривые титрования в концентрационно-логариф-мических координатах, когда по обеим осям откладывают логарифмы концентраций веществ, участвующих в реакции.
Реактивы, применяемые в титриметрическом анализе
Для приготовления растворов с точно известной концентрацией, применяемых в титриметрическом анализе, используют стандартные вещества (установочные вещества).
Первичное стандартное вещество (первичный стандарт) — вещество высокой чистоты, которое применяется для установления концентрации титранта — для стандартизации титранта, в основе чего лежит стехиометричность их взаимодействия, или может быть само использовано для приготовления раствора титранта с точно известной концентрацией.
Вторичное стандартное вещество (вторичный стандарт) — вещество, используемое для стандартизации; содержание активного компонента в нем находят с помощью первичного стандарта.
Первичные стандартные вещества должны удовлетворять ряду требований, важнейшими из которых являются: высокая чистота (строгая стехиометричность состава); устойчивость на воздухе; отсутствие гигроскопической влаги (вещества должны быть негигроскопичными), большая молярная масса эквивалента (что уменьшает относительную ошибку взвешивания), доступность, отсутствие токсичности.
В качестве первичные стандартов в титриметрическом анализе применяют буру — десятиводный кристаллогидрат тетрабората натрия Na2B4О7 • 10H2O, безводный карбонат натрия Nа2СО3, гидрокарбонат калия КНСО3, щавелевую кислоту H2C2O4, триметоксиметиламин (НОСН2)3СNН2, дихромат калия K2Cr2O7, бромат калия КВrО3, йодат калия КJO3, хлорид натрия NаСl, двунатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА, трилон Б) и др.
Стандартный раствор — раствор, имеющий известную концентрацию активного вещества.
Первичный стандартный раствор — приготовленный из первичного стандартного вещества. Стандартный раствор, концентрация которого известна по массе этого вещества в определенном объеме (или массе) раствора.
Вторичный стандартный раствор — раствор, концентрация которого установлена стандартизацией или приготовленный по известной массе вторичного стандартного вещества.
Стандартизация — процесс нахождения концентрации активного реагента в растворе (чаще всего путем титрования его стандартным раствором).
Иногда стандартные растворы готовят с помощью фиксаналов, которые представляют собой запаянные стеклянные ампулы, содержащие точно известное количество стандартного вещества или раствора (стандарт-титры). Для приготовления стандартного раствора из фиксанала содержимое ампулы количественно переносят в мерную колбу, доводят дистиллированной водой до метки и тщательно перемешивают раствор. Разработаны простые приемы количественного перенесения содержимого ампулы в мерную колбу. Соответствующие прописи обычно прилагаются к комплекту фиксанала.
Способы выражения концентраций в титриметрическом анализе
В титриметрическом анализе используют следующие основные способы выражения концентраций растворов.
Молярная концентрация с(А) —- количество растворенного вещества А в молях, содержащееся в одном литре раствора:
![]() ,
моль/л
,
моль/л
где m(А) — масса растворенного вещества А, г
М(А.) — молярная масса растворенного вещества А, г/моль.
Молярная концентрация эквивалента с(1/Z А), или нормальность (старое название),— количество растворенного вещества А в молях, соответствующее эквиваленту А, содержащееся в одном литре раствора:
![]() ,
моль/л
,
моль/л
где 1/Z — фактор эквивалентности; рассчитывается для каждого вещества на основании стехиометрии реакции;
M(1/ZА) — молярная масса эквивалента растворенного вещества А, г/моль.
Титр T(А) растворенного вещества А — это масса растворенного вещества А в граммах, содержащаяся в одном миллилитре раствора:
![]() ,
г/мл
,
г/мл
где объем раствора V измеряется в мл.
Титр раствора по определяемому веществу X, или титриметрический фактор пересчета t(Т/Х), — масса титруемого вещества, взаимодействующая с одним миллилитром титранта Т:
![]() ,
г/мл
,
г/мл
Поправочный коэффициент К — число, выражающее отношение действительной (практической) концентрации c(1/zA) вещества А в растворе к его заданной (теоретической) концентрации с(1/zА)теор:
К = c(1/zA)пр/c(1/zA)теор
