
- •Государственное бюджетное образовательное учреждение
- •Глава 2. Методика определения no3 - ……………………….……..Стр. 18
- •Глава 3. Экспериментальная часть…………………………………Стр. 36
- •Введение
- •Глава 1.Обзор литературы
- •1.1 Вода питьевая, ее качество
- •1.2 Общая характеристика нитратов
- •1.3 Нахождение нитратов в природе, их место в круговороте азота.
- •1.4 Использование нитратов в народном хозяйстве. Природные и антропогенные источники их поступления в окружающую среду.
- •1.5 Метаболизм нитратов в организме человека.
- •Глава 2.Методика определения no3 –
- •2.1 Потенциометрия
- •2.2Электроды
- •2.2.1.Классификацияэлектродов
- •2.2.2.Электроды сравнения
- •2.2.3 Ионоселективные электроды
- •2.3.Проблемы выбора электродов
- •Глава 3. Экспериментальная часть
- •3.1. Цели и задачи эксперимента.
- •3.2. Объекты исследования.
- •3.3. Отбор и хранение проб.
- •3.4. Определение нитратов ионометрическим методом.
- •3.4.1. Аппаратура,материалы и реактивы.
- •3.4.2. Приготовление растворов.
- •3.4.3. Подготовка электродов к работе.
- •3.4.4. Проведение анализа.
- •3.4.5. Построение градуировочного графика.
- •3.5 Результаты исследования и их обсуждения.
- •3.6 Выводы.
- •Заключение.
2.2.2.Электроды сравнения
Электроды сравнения это электрохимических системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения абсолютные величины потенциала отдельного электрода. В принципе в качестве электрода сравнения может служить любой электрод в термодинамически равновесном состоянии, удовлетворяющий требованиям воспроизводимости, постоянства во времени всех характеристик и относит, простоты изготовления. Для водных электролитов наиб, часто применяют в качестве электродов сравнения водородный, каломельный, галогеносеребряные, оксидно-ртутный и хингидронный электроды.
Водородный электрод сравнения представляет собой кусочек платиновой фольги или сетки, покрытый слоем электролитической платины и погруженный частично в раствор, через который пропускают Н2. При адсорбции на электроде образуются адсорбированные атомы Надс. Электродные реакции на водородном электроде сравнения описываются уравнениями: Н2↔ 2Надс↔2Н+ + 2е (е - электрон). Водородный электрод при давленииводорода рН2 равном 1 атм (1,01∙105 Па), термодинамической активности ионов водорода в растворе аН+, равной 1, называется стандартным водородным электродом, а его потенциал условно принимают равным нулю. Потенциалы других электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов. Для водородного электрода сравнения Нернста уравнение записывается в виде:
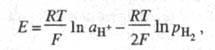
где Т - абсолютная. температура; F - постоянная Фарадея; R - газовая постоянная. При рН2 = 1 атм электродный потенциал
![]()
Используется в широком диапазоне рН - от значений, соответствующим концентрированным кислотам, до значений, соответствующим концентрированным щелочам. Однако в нейтральных растворах водородный электрод сравнения может нормально функционировать лишь при условии, что раствор обладает достаточно хорошими буферными свойствами. Это связано с тем, что при установлении равновесного потенциала на платинированной платине, а также при пропускании тока через водородный электрод сравнения появляется (или исчезает) некоторое количество ионов Н+, т. е. изменяется рН раствора, что особенно заметно в нейтральных средах. Водородный электрод применяют в широком интервале температур, отвечающем существованию водных растворов. Следует, однако, учитывать, что при повышении температуры парциальное давлениеводорода падает вследствие роста давленияпаров растворителя и обусловленное этим изменение потенциала электрода сравнения соответствует уравнению:
![]() ,
,
где р - барометрическое давление (в кПа), a ps - суммарное давление насыщенных паров над раствором (кПа). Возможность использования водородного электрода в орг. средах требует спец. проверки, т. к. Pt может катализировать процессы с участием органических соединений, вследствие чего нарушается равновесие электродной реакции и электрод приобретает стационарный потенциал, отличный от равновесного.
Каломельный
электрод
сравнения изготавливают, используя
ртуть
и растворы каломели
в хлориде
калия.
Электродная реакция на этом электроде
отвечает уравнению: 2Hg + 2Сl-![]() Hg2Cl2,
а соответствующее уравнение Нернста
имеет вид:
Hg2Cl2,
а соответствующее уравнение Нернста
имеет вид:
![]()
где E0 - стандартный потенциал. В зависимости от концентрации КС1 различают насыщенный, нормальный и децинормальный каломельные электроды сравнения. Эти электроды сравнения хорошо воспроизводимы, устойчивы и пригодны для работы при температурах до 80 °С. При более высоких температурах начинается разложение хлорида ртути. Часто каломельный электрод сравнения подсоединяют через солевой мостик, состоящий из концентрированного раствора КСl для снижения диффузионного потенциала. Потенциал Е каломельного электрода сравнения зависит от температуры, причем температурный коэффицент минимален для децинормального электрода, для которого Е =0,3365 - 6 ∙10-5(t-25), где t - т-ра (°С).
Галогеносеребряные
электроды
сравнения представляют собой серебряную
проволоку, покрытую галогенидом серебра,
который наносится путем термического
или электрохимического разложения
солисеребра.
Электродная реакция отвечает уравнению:
Ag + Hal-![]() AgHal
+ е (Hal - галоген),
а уравнение Нернста имеет вид:
AgHal
+ е (Hal - галоген),
а уравнение Нернста имеет вид:
![]()
Удобны при работе с электрохимическими ячейками без жидкостного мостика, применимы как в водных, так и во многих неводных средах, устойчивы при повышенных температурах. В области температур 0-95 °С потенциал хлорсеребряного электрода сравнения описывается уравнением:
E
= 0,23655 - 4,8564∙10-4t
- 3,4205∙10-6t2
+ 5,869∙10-9t3.
Оксидно-ртутный электрод
сравнения приготавливают из ртути
и насыщенных растворов оксида
ртути
в водном растворе щелочи.
Электродная реакция: Hg2O
+ 2e + H2O
↔ 2Hg + 2OH; уравнение Нернста:
![]()
Удобен при работе в щелочных растворах, т. к. при этом легко реализовать цепи без жидкостного соединения.
Хингидронный электрод сравнения представляет собой платиновую проволочку, опущенную в насыщенный раствор хингидрона. Электродная реакция: С6Н4(ОН)2↔ С6Н4О2 + 2Н+ + 2е. Стандартный потенциал E° = 0,6992В. Используется в интервале рН 0-6, а в буферных растворах в отсутствие сильных окислителей - до рН ≈ 8,5. В интервале температур 0-50°С потенциал хингидронного электрода сравнения выражается уравнением:
Е = 0,6992 - 7,4∙10-4(t - 25) + [0,0591 + 2∙10-4(t - 25)] ∙ lgaН+. При измерениях в неводных средах в принципе можно применять водные электроды сравнения, если создать воспроизводимую границу водного и неводного растворов и учитывать возникающий на этой границе диффузионный потенциал. Часто в неводных средах используют электроды сравнения на основе серебра в растворе его соли.
