
Свидунович_Материаловедение_для ХТОМ
.pdf
тельной или неограниченной растворимостью в твердом состоянии; при этом полная упорядоченность возникает при концентрациях твердого раствора, соответствующих простым атомным соотношениям компонентов типа АВ или АВ3. Частичная упорядоченность наблюдается при составах, близких к указанным. Расположение атомов в упорядоченных твердых растворах двух сплавов меди с золотом, составов, соответствующих концентрациям АuСu3 и AuCu, показано на рис. 1.15.
Возникновение и исчезновение порядка в расположении атомов твердых растворов сопровождается изменением свойств. При упорядочении возрастают электропроводность, температурный коэффициент электрического сопротивления, твердость и прочность; снижается пластичность сплава. У ферромагнитных сплавов изменяются магнитные свойства: например, у пермаллоев (магнитные сплавы железа с никелем) при упорядочении в несколько раз уменьшается магнитная проницаемость. Некоторые сплавы в неупорядоченном состоянии парамагнитны, а после упорядочения становятся ферромагнитными, например сплавы Гейслера (Mn-Cu-Аl).
Твердые растворы внедрения. Такие твердые растворы возникают при сплавлении переходных металлов с неметаллами, имеющими малый атомный радиус — водородом, азотом, углеродом, бором.
Основным условием, определяющим возможность растворения путем внедрения, является размерный фактор. Размер межузельного атома должен быть несколько больше размера поры.
Твердые растворы внедрения всегда имеют ограниченную растворимость и встречаются преимущественно тогда, когда растворитель имеет ГП или ГЦК решетки, в которых имеются поры с радиусом 0,41R, где R — радиус атома растворителя. В ОЦК решетке растворимость путем внедрения мала, так как размер пор не превосходит 0,29R.
Примером твердых растворов внедрения, имеющих промышленное значение, являются твердые растворы углерода в Feγ и Feα. Так, Feγ с ГЦК решеткой растворяет до 2,14 % (маc.) углерода, a Feα с ОЦК решеткой почти
совсем его не растворяет (максимальная растворимость составляет около 0,02 % (маc.)).
Искажения решетки при образовании твердых растворов внедрения больше, чем при образовании твердых растворов замещения, поэтому у них более резко изменяются и свойства. По мере увеличения концентрации растворенного элемента в твердом растворе заметно возрастают электрическое сопротивление, твердость и прочность, но и значительно понижаются пластичность и вязкость.
Всплавах, содержащих более двух элементов, возможно растворение в одном и том же растворителе и путем замещения, и путем внедрения. Так, при сплавлении железа с марганцем и углеродом получится твердый раствор,
вкотором марганец растворяется путем замещения, а углерод — путем внедрения.
Взаключение следует подчеркнуть, что твердые растворы — это кристаллы, наиболее близкие по свойствам к растворителю, так как сохраняют его кристаллическую решетку и тип связи. В частности, твердые растворы на основе металлов отличаются высокой технологической пластичностью: хорошо деформируются в горячем, а многие и в холодном состоянии.
Твердые растворы составляют основу большинства промышленных конструкционных сплавов и сплавов специального назначения.
ПРОМЕЖУТОЧНЫЕ ФАЗЫ
Кристаллы, образованные различными элементами и имеющие собственный тип кристаллической решетки, отличающийся от решеток, составляющих их элементов, называются промежуточной фазой.
В зависимости от природы элементов в промежуточных фазах может быть любой тип связи, который, в первую очередь, и определяет свойства кристаллов, в частности электрические свойства.
Расположение атомов (или ионов) в решетке может быть неупорядоченным либо полностью или частично упорядоченным.
Промежуточные фазы, как и твердые растворы, являются кристаллами, существующими в некотором интервале концентраций, иногда очень малом. Переменный состав объясняется либо наличием небольших межузельных «лишних» атомов (или ионов) в кристаллической решетке промежуточной фазы, либо недостатком атомов в узлах решетки.
Промежуточные фазы обозначают так же, как и твердые растворы, буквами греческого алфавита. Однако допускаются обозначения и химическими формулами, которые отражают состав (стехиометрический), при котором кристаллы не имеют дефектов — межузельных атомов и вакансий.
Пока не существует полной классификации многочисленных и разнообразных промежуточных фаз. Замечено, что структура промежуточной фазы зависит от трех факторов: относительного размера атомов, их валентности и от положения в Периодической системе элементов, что определяет их электронную структуру.
Системы металл — неметалл Фазы с ионным типом связи. К ним относятся оксиды металлов.
Простой оксид железа FeO имеет ГЦК решетку (см. рис. 1.13). Все кислородные узлы решетки заполнены, тогда как часть металлических узлов свободна. Таким образом, оксид FeO имеет структуру с большим дефицитом металлических ионов, что определяет появление полупроводниковых свойств.
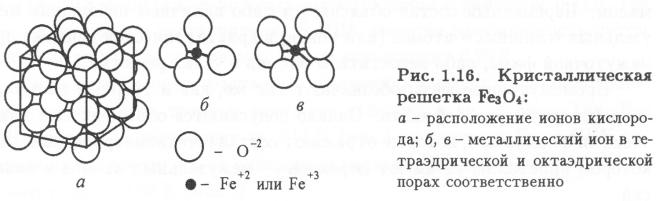
Оксид железа Fe3O4 — это двойной оксид FeO × F е2О3 (рис. 1.16).
Его кристаллическая решетка — шпинель содержит двух- и трехвалентные ионы железа, расположенные в межузельных порах ионов кислорода. Два вида ионов железа и ионный тип связи обеспечивают оксиду особые магнитные свойства в высокочастотных полях. Большая плотность упаковки ионов в решетке, несмотря на небольшой дефицит ионов железа, способствует высокому сопротивлению химической коррозии.
Фазы с ионно-ковалентным типом связи. Такие фазы образуются при взаимодействии металлов I — III группы с неметаллами V — VI группы подгруппы В Периодической системы элементов (например, ZnS и АlР). Эти фазы обладают полупроводниковыми свойствами.
Фазы с ковалентно-металлическим типом связи. Фазы, в которых преобладает металлический тип связи, образуются при взаимодействии переходных металлов с углеродом, азотом, бором и водородом и называются соответственно карбидами, нитридами, боридами, гидридами.
Кристаллическая структура этих соединений зависит от относительных размеров атомов неметалла Rим и металла RM. Если отношение RИМ/RM < 0,59, образуются промежуточные фазы с простыми пространственными решетками, в которых атомы неметалла располагаются в порах. Эти промежуточные фазы называют фазами внедрения. Если отношение RИМ/RИМ > 0,59, то атом неметалла не может разместиться в поре, тогда образуются сложные пространственные решетки с большим числом атомов в элементарной ячейке.
Фазы внедрения имеют кристаллические решетки (чаще всего плотноупакованные ГЦК и ГП); при этом тип решетки фазы внедрения не совпадает с типом решетки металла, образующего эту фазу (исключением являются некоторые гидриды). Атомы металла в фазах внедрения

размещаются в узлах решетки, тогда как атомы неметалла закономерно распределяются в октаэдрических или тетраэдрических порах решетки.
Химический состав фаз внедрения указывается формулами: МеХ, Ме2Х, Ме4Х и МеХ4, где Me — металл, X — неметалл; однако это фазы переменного состава, в которых число неметаллических атомов отличается от стехиометрического состава.
Кфазам внедрения типа МеХ относятся следующие карбиды: TiC, NbC, WC, МоС, VC. Вольфрам и молибден могут образовывать и фазы
внедрения типа Ме2Х: МО2С и W2C. Примером фазы внедрения типа Ме4Х является нитрид железа Fe4N, а фазы типа МеХ4 — гидрид циркония ZrH4.
В карбиде TiC фактическое содержание углерода, который располагается в межузельных порах, может колебаться в пределах 38…50 % (ат.). Очевидно, что только при 50 % (ат.) С состав карбида точно описывается формулой TiC.
В фазах внедрения преобладает металлическая связь, чем и определяются такие их свойства, как высокая электрическая проводимость, положительный коэффициент электросопротивления (как у чистых металлов и твердых растворов на их основе)^некоторые фазы внедрения обладают сверхпроводимостью. Однако есть свойства, которые указывают на значительную долю в фазах внедрения ковалентной связи. Большинство фаз внедрения чрезвычайно тугоплавки и имеют высокую твердость.
Карбиды и нитриды, относящиеся к фазам внедрения, присутствуют в структуре многих коррозионно-стойких, износостойких и жаропрочных
конструкционных сталей. Карбиды TiC, ТаС, WC, W2C служат основой порошковых твердых сплавов для режущих инструментов.
Ккарбидам с отношением RИМ/RM > 0,59 относятся Fе3С (в сталях его
называют цементитом), МnС, Сr23С6 и Сr7С3 (например, в Fе3С отношение Rc/Rfe = 0,605). Карбиды Fe3C, Сr23С6 и Сr7Сз — важнейшие промежуточные фазы в конструкционных и инструментальных сталях, во
многом, определяющие их свойства. В последних двух карбидах преобладает металлическая связь, хотя имеется и определенная доля ковалентной. Эти промежуточные фазы отличаются высокой твердостью и хрупкостью, они также достаточно тугоплавки, но уступают по этим свойствам карбидам, являющимся фазами внедрения.
Системы металл— металл При сплавлении металлов могут образовываться промежуточные фазы
с металлическим типом связи. К ним относятся электронные фазы, фазы Лавеса и σ-фазы.
Электронные фазы. Для максимального содержания металла более высокой валентности характерно совершенно определенное значение электронной концентрации2: 3/2, 21/13, 7/4. Фазы с указанными значениями электронной концентрации принято обозначать β,γ и ε соответственно.
Указанным электронным концентрациям можно приписать соответ-
2 Отношение числа валентных электронов к числу атомов.
ствующие химические формулы. Например, в сплавах меди с цинком, в которых могут образоваться все фазы с указанными концентрациями, такими формулами будут соответственно CuZn, Cu5Zn8, CuZn3.
В большинстве сплавов β-фазы имеют ОЦК решетку, γ-фазы — сложную кубическую решетку с 52 атомами в элементарной ячейке и ε-фазы — ГП решетку.
Свойства электронных соединений, в частности механические свойства, зависят в значительной мере от упорядоченности атомов компонентов в кристаллической решетке электронного соединения. Так, β-фазы с ОЦК решеткой почти во всех системах при высоких температурах неупорядочены, и в этом состоянии их свойства близки к свойствам твердых растворов, т.е. они не отличаются высокой твердостью и обладают хорошей пластичностью. При низких температурах неупорядоченные β-фазы неустойчивы: они либо распадаются на двухфазные смеси, либо упорядочиваются, как, например, в системе Си—Zn. Упорядоченные β-фазы значительно более тверды и хрупки. Почти всегда упорядочены, причем вплоть до температуры плавления, и во всех системах обладают хрупкостью γ-фазы ε-фазы всегда имеют неупорядоченное строение.
Электронные соединения присутствуют в структуре многих сплавов на медной основе: латунях (Си—Zn), бронзах (Си— Аl, Си—Sn и др.); они являются упрочняющими фазами.
Фазы Лавеса. Эти промежуточные фазы практически постоянного состава АВ2 образуются при взаимодействии металлов самых различных групп Периодической системы элементов; при этом атомный радиус элемента В должен быть меньше, чем атомный радиус элемента А, на 20...
30%.
Фазы Лавеса имеют упорядоченные сложные кубические или гексагональные решетки, в магнитном поле они ведут себя как диамагнети-ки. Фазы Лавеса, образованные переходными металлами (NbFe2, MoFe2, TiFe2, ТiCr), присутствуют в структуре некоторых жаропрочных сплавов и способствуют их упрочнению.
Сигма-фазы. Эти фазы переменного состава образуются при сплавлении переходных металлов, имеющих близкие размеры атомов, σ-фазы имеют частично упорядоченную сложную решетку. В железных сплавах, содержащих более 20 % (маc.) Сr (используются как коррозионно-стойкие конструкционные материалы), медленное охлаждение из области твердого раствора или изотермическая выдержка при 800 ... 600° С приводит к образованию кристаллов σ-фазы, которое сопровождается увеличением твердости и охрупчиванием сплавов.
ДЕФЕКТЫ КРИСТАЛЛОВ
Строение реальных кристаллов отличается от идеальных. В реальных кристаллах всегда содержатся дефекты, которые подразделяют на точечные, линейные, поверхностные и объемные. Размеры точечного дефекта близки к

межатомному расстоянию. У линейных дефектов длина на несколько порядков больше ширины; у поверхностных дефектов мала толщина, а ширина и длина больше ее на несколько порядков. Объемные дефекты (поры, трещины) имеют значительные размеры во всех трех направлениях.
Дефекты сохраняют подвижность, способны перемещаться в кристаллической решетке и при сближении взаимодействуют между собой. В большинстве случаев подвижность дефектов контролируется диффузией. Передвижение дислокаций под действием напряжений не связано с массопереносом, дислокации подвижны и при низких температурах, когда диффузия уже не играет никакой роли.
ТОЧЕЧНЫЕ ДЕФЕКТЫ
К самым простым точечным дефектам относятся вакансии, межузельные атомы основного вещества, чужеродные атомы внедрения (рис.
1.17).
Вакансией называется пустой узел кристаллической решетки, а межузельным атомом — атом, перемещенный из узла в позицию между узлами.
Вакансии и межузельные атомы появляются в кристаллах при любой температуре выше абсолютного нуля из-за тепловых колебаний атомов. Каждой температуре соответствует равновесная концентрация вакансий, а также межузельных атомов. Например, в меди при 20-25° С содержится 10~13 % (ат.) вакансий, а вблизи точки плавления — уже 0,01 % (ат.) (одна вакансия приходится на 104 атомов).
Пересыщение точечными дефектами достигается при резком охлаждении после высокотемпературного нагрева, при пластическом деформировании и при облучении нейтронами. В последнем случае концентрация вакансий и межузельных атомов одинакова: выбитые из узлов решетки атомы становятся межузельными атомами, а освободившиеся узлы становятся вакансиями.

С течением времени избыток вакансий сверх равновесной концентрации уничтожается на свободных поверхностях кристалла, порах, границах зерен и других дефектах решетки. Места, где исчезают вакансии, называются стоками вакансий. Вакансии являются самой важной разновидностью точечных дефектов; они ускоряют все процессы, связанные с перемещениями атомов (диффузия, спекание порошков и т.д.).
В ионных и ковалентных кристаллах вакансии и другие точечные дефекты электрически активны и могут быть как донорами, так и акцепторами. Это создает в кристаллах преобладание определенного типа проводимости. В ионных кристаллах электрическая нейтральность кристалла сохраняется благодаря образованию пары точечных дефектов: вакансия-ион, у которых электрические заряды имеют противоположные знаки.
Все виды точечных дефектов искажают кристаллическую решетку и, в определенной мере, влияют на физические свойства. В технически чистых металлах точечные дефекты повышают электросопротивление, а на механические свойства почти не влияют. Лишь при больших концентрациях дефектов в облученных металлах понижается пластичность и заметно изменяются другие свойства.
ЛИНЕЙНЫЕ ДЕФЕКТЫ
Важнейшие виды линейных несовершенств — краевые и винтовые дислокации (рис. 1.18). Краевая дислокация в сечении представляет собой край «лишней» полуплоскости в решетке (см. рис. 1.18, а). Вокруг дислокаций решетка упруго искажена.
Мерой искажения служит так называемый вектор Бюргерса. Он получается, если обойти замкнутый контур в идеальном кристалле (рис. 1.19, а), переходя от узла к узлу, а затем этот же путь повторить в реальном кристалле, заключив дислокацию внутрь контура. Как видно на рис. 1.18,6 в реальном кристалле контур окажется незамкнутым. Вектор 6, который нужен для замыкания контура, называется вектором Бюргерса. У краевой дислокации вектор Бюргерса равен межатомному расстоянию и перпендикулярен дислокационной линии, у винтовой дислокации — параллелен ей.

Полные дислокации легко перемешаются под действием напряжений в отличие от частичных дислокаций, у которых вектор Бюргерса меньше межатомного расстояния.
Внутри кристалла дислокации связаны в единую объемную сетку; в каждом узле сетки соединены три дислокации и сумма их векторов Бюргерса равна нулю.
В кристаллах содержатся дислокации разных знаков, различающиеся ориентацией векторов Бюргерса. Дислокации одного знака, расположенные в одной плоскости, отталкиваются друг от друга, а противоположных знаков
— притягиваются.
Плотность дислокаций — это суммарная длина всех линий дислокаций в единице объема. В полупроводниковых кристаллах она равна 104 — 10 5 см- 2, у отожженных металлов — 10 6 — 10 8 см-2. При холодном пластическом деформировании плотность дислокаций возрастает до 1011 - 1012 см-2. Попытка увеличить плотность свыше 1012 см-2 быстро приводит к появлению трещин и разрушению металла.
Дислокации возникают при кристаллизации, плотность их большая, поэтому они значительно влияют на свойства материалов. Дислокации наряду с другими дефектами участвуют в фазовых превращениях.
Вдоль дислокаций скорость диффузии на несколько порядков выше, чем сквозь кристаллическую решетку без дефектов. Дислокации служат местом концентрации примесных атомов, в особенности примесей внедрения, так как это уменьшает искажения решетки. Примесные атомы образуют вокруг дислокации зону повышенной концентрации — так называемую атмосферу Коттрелла, которая мешает движению дислокаций и упрочняет металл.
Особенно велико влияние дислокаций на прочность кристаллов. Благодаря подвижным дислокациям экспериментально определенный предел текучести металлов в 1000 раз меньше теоретического значения. При значительном увеличении плотности дислокаций и уменьшении их подвижности прочность увеличивается в несколько раз по сравнению с отожженным состоянием. Прочность бездефектных участков (в том числе длинных и

тонких «усов», полученных кристаллизацией из газовой фазы) приближается к теоретической (рис. 1.20).
ПОВЕРХНОСТНЫЕ ДЕФЕКТЫ
Наиболее важными поверхностными дефектами являются большеугловые и малоугловые границы, дефекты упаковки, границы двойников.
Поликристаллический сплав содержит огромное число мелких зерен. В соседних зернах решетки ориентированы различно (рис. 1.21), и граница между зернами представляет собой переходный слой шириной 1 — 5 нм. В нем нарушена правильность расположения атомов, имеются скопления дислокаций, повышена концентрация примесей. Границы между зернами называются болыиеугловыми, так как соответственные кристаллографические направления в соседних зернах образуют углы в десятки градусов (см.
рис. 1.21, а).
Каждое зерно, в свою очередь, состоит из субзерен (блоков). Субзерно представляет собой часть кристалла относительно правильного строения, а его границы — стенки дислокаций, которые разделяют зерно на отдельные субзерна (см. рис. 1.21, б). Угол взаимной разориентации между соседними субзернами невелик (не более 5°), поэтому такие границы называются
малоугловыми. На малоугловых границах также скапливаются примеси. Дефект упаковки представляет собой часть атомной плоскости, огра-
ниченную дислокациями, в пределах которой нарушен нормальный порядок чередования атомных слоев. Например, в сплавах с ГЦК решеткой чередуются плотноупакованные слои АВCABCAB..., а при прохождении через дефект упаковки слои чередуются в последовательности ABCВСABC... Чередование слоев ВСВС...типично для кристаллов с ГП решеткой, и, таким образом, дефект упаковки представляет собой как бы тонкую пластинку с ГП решеткой в ГЦК решетке.
Поверхностные дефекты влияют на механические и физические свойства материалов. Особенно большое значение имеют границы зерен. Предел текучести σт связан с размером зерен d зависимостью σт = σ0+kd-1/2, где «то и А; — постоянные для данного материала. Чем мельче зерно, тем выше предел текучести, вязкость и меньше опасность хрупкого разрушения. Аналогично, но более слабо влияет на механические свойства размер субзерен.
Вдоль границ зерен и субзерен быстро протекает диффузия (во много раз быстрее, чем сквозь кристалл), особенно при нагреве. Взаимодействие между дефектами, перемещение их в кристаллах, изменение концентрации дефектов — все это отражается на свойствах и имеет большое практическое значение.
ЖИДКИЕ КРИСТАЛЛЫ
Жидкие кристаллы — это жидкости с упорядоченной молекулярной структурой. Благодаря упорядочению молекул они занимают промежуточное положение между кристаллами и обычными жидкостями с беспорядочным расположением молекул. Жидкие кристаллы текучи, как обычные жидкости, но в то же время обладают анизотропией свойств, как кристаллы.
Жидкие кристаллы образуются органическими веществами, молекулы которых имеют удлиненную форму и проявляют определенную жесткость вдоль продольной оси. Повышению жесткости способствуют плоские сегменты в самих молекулах, например бензольные кольца. Наличие полярных групп на концах молекул (или легко поляризуемых групп атомов) также способствует появлению жидкокристаллического состояния.
Упорядоченная молекулярная структура возникает при достаточной подвижности молекул вещества, образующего жидкие кристаллы. Это необходимое условие достигается при плавлении или растворении вещества. В первом случае жидкие кристаллы называются термотропными, во втором
— лиотропными.
Жидкокристаллическое состояние, возникшее при плавлении органического вещества, сохраняется от точки плавления вещества до точки перехода в изотропную жидкость. При переходе из-за усилившихся тепловых колебаний упорядоченная молекулярная структура полностью исчезает, увеличивается прозрачность вещества, и поэтому верхнюю температурную
