
- •(ЧитГу)
- •Индивидуальные домашние задания по химии
- •1. Классы неорганических соединений
- •12,73 Г г раствора, тогда г
- •Вариант 2
- •Вариант 5
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •2. Химический эквивалент
- •Решение. Эквивалент есть количество вещества и выражается в молях.
- •Решение. Эквивалентную массу koh рассчитаем по формуле:
- •Решение. Эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
- •3. Строение атома
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 1
- •Вариант 5
- •Вариант 17
- •Вариант 18
- •5. Химическая термодинамика
- •Вариант 9
- •Вариант 1
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 18
- •11. Свойства металлов
- •Вариант 11
- •Вариант 21
- •Библиографический список
- •672039, Чита, ул. Александрово-Заводская, 30
Вариант 1
Какие из указанных ионов могут образовывать между собой малодиссоциирущие вещества: NH4+, OH-, CH3COO-, H+, SO42-, Ca2+?
Составьте молекулярные и ионно-молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения:
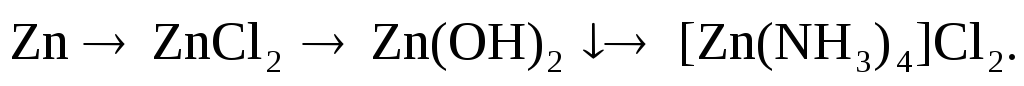
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Na2S, Al(NO3)3 и укажите реакцию их водных растворов.
Вариант 2
В какую сторону сместится диссоциация слабого электролита раствора угольной кислоты (H2CO3), если добавить: а) NaCl; б) Na2CO3; в) HCl?
Напишите молекулярные и ионно-молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения:
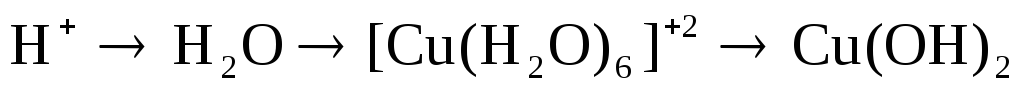
Напишите молекулярно-ионные формы уравнений гидролиза солей Cu(NO3)2, NH4CH3COO и укажите реакцию их водного раствора.
Вариант 3
Какие из указанных ионов, соединяясь между собой, образуют малодиссоцирующие вещества: K+, Na+, NH4+, OH-, SO42-, CH3COO-, H+.
В какую сторону сместится диссоциация слабого электролита гидразина (NH2OH), если к его раствору добавить: а) NaNO3; б) HNO3.
Напишите молекулярно-ионные формы уравнений гидролиза солей Na3PO4, (NH4)2S и укажите реакцию их водных растворов.
Вариант 4
Какие из ионов, соединяясь между собой, образуют малодиссоцирующие соединения: K+, Na+, Cu2+, NO3–, NH4+, SO42-, OH-?
В какую сторону сместится равновесие любого электролита, если к раствору сероводородной кислоты добавить: а) Na2SO4; б) NaOH; в) H2SO4.
Напишите молекулярно-ионные формы уравнений гидролиза солей FeCl3, CH3COONа и укажите реакцию их водных растворов.
Вариант 5
Какие из написанных ионов, соединяясь между собой, образуют малодиссоцирующие вещества: H+, SO42-, CH3COO-, Na+, K+, OH-?
Напишите молекулярные и ионно-молекулярные уравнения реакции, с помощью которых можно осуществить следующие превращения:


 Cu
Cu2+
Cu(OH)2
[Cu(NH3)4]+2.
Cu
Cu2+
Cu(OH)2
[Cu(NH3)4]+2.
Напишите молекулярно-ионные формы уравнений гидролиза солей K2CO3, Fe(NO3)3 и укажите реакцию их водных растворов.
Вариант 6
Реакции между какими ионами протекают практически до конца NO3-, PO43-, SO42-, S2-, K+, Na+, NH4+, H+.
Составьте молекулярные и ионно-молекулярные уравнения реакций, с помощью которых можно будет осуществить следующие превращения:
M

 gSO4
Mg(OH)2
Mg(NO3)2
Mg3(PO4)2.
gSO4
Mg(OH)2
Mg(NO3)2
Mg3(PO4)2.
При гидролизе какой соли, находящейся на воздухе, эта соль будет уменьшаться по массе: NaCl, Na2SO4, NH4Cl, Na2SO3, (NH4)2CO3.
Вариант 7
Реакции между какими ионами протекают практически до конца: Ca2+, Mg2+, Zn2+, Fe2+, Cl-, NO3-, PO43-, CH3COO-, OH-.
Составьте ионные и молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения:



 Fe
Fe2+
Fe3+
Fe(OH)3
.
Fe
Fe2+
Fe3+
Fe(OH)3
.
Напишите молекулярно-ионные формы уравнений гидролиза солей (NH4)2HPO4, BaS, KNO2 и укажите реакцию их водных растворов.
Вариант 8
Реакции между какими ионами протекают практически до конца CO32-, NO3-, PO43-, SO42-, Na+, K+, NH4+, H+.
Составьте ионные и молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения:



 Cr
Cr3+
Cr(OH)3
Cr(OH)6
CrO42-.
Cr
Cr3+
Cr(OH)3
Cr(OH)6
CrO42-.
При гидролизе каких солей pH среды будет меньше 7: NaCl, Na2SO4, Na2CO3, FeCl3. Составьте ионно-молекулярные уравнения гидролиза этих солей.
Вариант 9
Реакции между какими ионами протекают практически до конца: SO42-, Сl-, OH-, NO3-, K+, Na+, NH4+, Ca2+.
Н
апишите молекулярные и ионные уравнения реакций, с помощью которых можно осуществить следующие превращения:



 SO3
SO42-
BaSO4
.
SO3
SO42-
BaSO4
.
Напишите молекулярные и ионные формы уравнений гидролиза солей: FeCl3, Fe(CH3COO)3. Какая среда будет в каждом конкретном случае.
Вариант 10
Реакции между какими ионами протекают практически до конца: Na+, PO43-, NH4+, Cl-, OH-, H+.
Составьте молекулярные и ионные уравнения реакций, с помощью которых можно осуществить следующие превращения:


 Na
NaOH
NaHCO3
NaCl.
Na
NaOH
NaHCO3
NaCl.
Напишите молекулярные и ионные формы уравнений гидролиза солей (NH4)2SO4, Na2SO4, Fe(NO3)3 и укажите реакцию их водных растворов.
Вариант 11
Напишите диссоциацию в воде следующих электролитов: Ba(OH)2, NH4CH3COO, H3BO3
Составьте по 3 молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Cu2+ + S2-=CuS;
б) SiO32- + 2H+=H2SiO3.
3. Напишите молекулярные и ионные формы уравнений гидролиза солей: Ca(HS)2, Al2(SO4)3 и укажите реакцию их водных растворов.
Вариант 12
Напишите ступенчатую диссоциацию в воде следующих солей: Na3PO4 и Al(NO3)3.
Вычислить pH 0,001М раствора угольной кислоты, KI H2CO3=4,5∙10-7.
Напишите молекулярные и ионные формы уравнений гидролиза солей ZnBr2, KCN и укажите реакцию их водных растворов.
Вариант 13
Составьте формулы средних и кислых солей, содержащих ионы NH4+ и Fe3+, NO3- и (CrO4)2-.
Напишите в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ: Pb(CH3COO)2 и Na2S; KHS и H2SO4. Для каждого случая укажите причину смещения равновесия в сторону прямой реакции.
Напишите молекулярно-ионные формы уравнений гидролиза солей Na2HPO4, K2S и укажите реакцию их водных растворов.
Вариант 14
Составьте формулы средних и кислых солей, содержащих ионы Na+ и Zn2+ и анионы SO42- и PO43-.
Напишите ионные и молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: Сa(OH)2 и CO2; Ca(OH)2 и CO2 (избыток). Для каждого случая укажите причину смещения равновесия в сторону прямой реакции.
Напишите молекулярно-ионные формы уравнений гидролиза солей Ba(NO3)3, Na2SO4 и укажите реакцию их водных растворов.
Вариант 15
Составьте формулы средних и кислых солей магния и кальция и кислот угольной и серной.
Напишите в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ: HCl и NaHCO3; FeCl3 и KOH. Для каждого случая укажите причину смещения равновесия в сторону прямой реакции.
Напишите молекулярно-ионные формы уравнений гидролиза солей (NH4)2CO3, Na2SO4 и укажите реакцию их водных растворов.
Вариант 16
Составьте формулы нормальных и кислых солей калия и кальция, образованных:
а) угольной кислотой;
б) мышьяковистой кислотой.
Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) Na2CO3 и CaCl2;
б) CuCl2 и Na3PO4.
Cоставьте ионно-молекулярные уравнения гидролиза солей BaCl2, (NH4)2SO3. Какое значение pH (> 7 <) имеют растворы этих солей.
Вариант 17
Составьте формулы средних и основных солей висмута (Bi3+) и анионов NO3- и Cl-.
Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) HCl и CaSO4;
б) FeS и H2SO4.
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей CrCl3, Al(CH3COO)3 и укажите реакцию их водных растворов.
Вариант 18
Составьте формулы средних, основных и кислых солей, содержащих ионы железа(III) и ионы хлора, ионы Na+ и ионы фосфата PO43- .
Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и (NH4)2S; б) MgCl2 и Na2CO3.
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей (NH4)2SO3, (NH4)2S. Какое значение pH (>7<) имеют растворы этих солей.
Вариант 19
Составьте формулы средних, основных и кислых солей магния и кальция и кислот угольной и серной, напишите реакции их электролитической диссоциации.
Напишите молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между:
а) Na HCO3 и HCl;
б) Zn(NO3)2 и KOH (избыток).
Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Cr2(SO4)3 и AlCl3. Какое значение pH (>7<) имеют растворы этих солей.
Вариант 20
1. Составьте формулы солей, образованных следующими катионами и анионами:
а) K+ и MnO4-; б) Al3+ и OH-;
в) NH4+ и Cr2O72-; г) Al3+ и CH3COO-.
2. Пользуясь схемой, составьте ионные уравнения:
 FeS +
2HCl H2S
+ FeCl2;
FeS +
2HCl H2S
+ FeCl2;
 CaCO3
+ 2HCl CO2
+ H2O
+ CaCl2.
CaCO3
+ 2HCl CO2
+ H2O
+ CaCl2.
3. Укажите характер среды и напишите молекулярно-ионные формы гидролиза солей: NH4CH3COOH , KCl.
Вариант 21
Составьте формулы солей, образованных следующими катионами и анионами:
а) Fe3+ и NO3-; б) Ca2+ и SO42-;
в) Mn4+ и OH-; г) NH4+ и PO43-.
Пользуясь схемой, составьте ионные и молекулярные уравнения: Al(OH)3 + 3 NaОН = AlO3-3 + H2O;
 Al(OH)3
+ 3 NaOH Na3[Al(OH)6].
Al(OH)3
+ 3 NaOH Na3[Al(OH)6].
Укажите характер среды и напишите молекулярно-ионные формы гидролиза солей Na2SO4 и Na2CO3.
Вариант 22
1. Составьте формулы солей, образованных следующими катионами и анионами:
а) K+ и PO43-; б) Al3+ и NO3-;
в) Сa2+ и CO32-; г) B3+ и SO42-.
2. Пользуясь схемой, составьте ионные уравнения:

 Ba(NO3)2
+ MgSO4
Mg(NO3)2
+ BaSO4
Ba(NO3)2
+ MgSO4
Mg(NO3)2
+ BaSO4
 BaCl2
+ CuSO4
BaSO4
+ CuCl2.
BaCl2
+ CuSO4
BaSO4
+ CuCl2.
3. Укажите характер среды и напишите молекулярно-ионные формы гидролиза солей: MgCO3 и Fe(NO3)3.
Вариант 23
Составьте формулы солей, образованных следующими катионами и анионами:
а) Al3+ и Cl-; б) K+ и S-2;
в) Ca2+ и SO42-; г) Fe2+ и CO32-.
Пользуясь схемой, составьте ионные уравнения:
 K2CO3
+BaCl2
BaCO3
+
2 KCl;
K2CO3
+BaCl2
BaCO3
+
2 KCl;
 Na2CO3
+ KCl K2CO3
+
2 NaCl .
Na2CO3
+ KCl K2CO3
+
2 NaCl .
Укажите характер среды и напишите молекулярно-ионные формы гидролиза солей: Na3PO4, FeCl3.
Вариант 24
Составьте формулы солей, образованных следующими катионами и анионами:
а) Na+ и NO3-; б) Li+ и HSO-;
в) Ca2+ и NO3-; г) Ca2+ и HSO4-.
Пользуясь схемой, составьте ионные уравнения:

 Na2S
+ FeSO4
FeS
+ Na2SO4;
Na2S
+ FeSO4
FeS
+ Na2SO4;
 2FeCl3
+
3CaCO3
Fe2(CO3)3
+ 3 CaCl2.
2FeCl3
+
3CaCO3
Fe2(CO3)3
+ 3 CaCl2.
Укажите характер среды и напишите молекулярно-ионные формы гидролиза солей: CaS, CrCl3.
Вариант 25
Реакция между какими ионами протекают практически до конца: NO3-, PO43-, SO42-, S2-, K+, Na+, NH4+, H+.
Составьте ионные и молекулярные уравнения реакций, с помощью которых можно осуществить следующие превращения:


 Zn
Zn2+
Zn(OH)2
[Zn(NH3)4]2+.
Zn
Zn2+
Zn(OH)2
[Zn(NH3)4]2+.
При гидролизе какой соли, находящейся на воздухе, эта соль будет уменьшаться по массе: NaCl, Na2SO4, NH4Cl, Na2CO3, (NH4)2CO3. Напишите уравнения гидролиза этой соли.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными реакциями называются реакции, сопровождающиеся переходом электронов от одних атомов или ионов к другим. Существует несколько типов реакций окисления-восстановления: реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции межмолекулярного окисления-восстановления.
При составлении схем окислительно-восстановительных реакций можно использовать как метод электронного баланса, так и метод полуреакций – электронно-ионный.
Пример 1. Расставьте коэффициенты методом электронного баланса в следующем уравнении: NaCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H2O.
Решение. Определим вещество, являющееся окислителем и вещество, являющееся восстановителем, а также их степени окисления до и после реакции. Хром с окислительным числом +3: Cr+3, расположенный в левой части уравнения, является восстановителем – он отдает три электрона, превращаясь в хром с окислительным числом +6: Сr+6, расположенный в правой части уравнения. Молекула Br2 является окислителем, она принимает два электрона, превращаясь в два иона брома (2Br–).
Составим электронные уравнения, выражающие процессы отдачи и принятия электронов, и найдем коэффициенты при окислителе и восстановителе:
 2 Cr+3
– 3e
→ Cr+6
– окисление
2 Cr+3
– 3e
→ Cr+6
– окисление
3 Br20 + 2e → 2Br– – восстановление
2. Напишем в левой части уравнения исходные вещества с найденными коэффициентами, а в правой формулы образующихся веществ с соответствующими коэффициентами: 2Cr+3 + 3Br20 → 2Cr+6 + 2Br–
3. Расставим полученные коэффициентов в уравнение реакции, дописав недостающие коэффициенты в веществах, не изменивших степени окисления:
2NaCrO2 + 3Br2 + 8NaOH = 2Na2CrO4 + 6NaBr + 4H2O.
Восстан-ль Окис-ль Среда
Пример 2. Составить уравнение реакции сульфида мышьяка (III) As2S3 с концентрированной азотной кислотой по схеме
A2S2 + NO3– → AsO43– + SO42– + NO2 + H2O.
Решение. A2S2 – это восстановитель, NO3– – это окислитель, поэтому в сульфиде мышьяка, согласно схеме, окисляются одновременно атомы с положительной и отрицательной степенями окисления. Составим соответствующие уравнения полуреакций:
A2S3 + 20H2O – 28e = 2AsO43– + 3SO42– + 4OH–;
Это процесс окисления восстановителя (первая полуреакция).
Процесс восстановления окислителя (вторая полуреакция) записывется следующим образом:
NO3– + 2H+ + e = NO2 + H2O;
Далее необходимо уравнять число отданных и принятых электронов и отобразить это следующей схемой:
A
 2S3
+ 20H2O
– 28e = 2AsO43–
+ 3SO42–
+ 4OH–; 1
2S3
+ 20H2O
– 28e = 2AsO43–
+ 3SO42–
+ 4OH–; 1
N
 O3–
+ 2H+
+ e = NO2
+ H2O; 28
O3–
+ 2H+
+ e = NO2
+ H2O; 28
A2S3 + 20H2O + 28NO3– + 56H+ = 2AsO43– + 3SO42– + 4OH– + 28NO2 + 28H2O;
После приведения подобных членов получим:
A2S3 + 28NO3– + 16H+ = 2AsO43– + 3SO42– + 28NO2 + 8H2O.
В молекулярной форме данное уравнения имеет вид:
A2S3 + 28HNO3 = 2H3AsO4 + 3H2SO4 + 28NO2 + 8H2O.
При вычислении эквивалентов элементов и их соединений необходимо учитывать, что эквивалент окислителя (восстановителя) равен его молекулярной массе, деленной на число электронов, которое приобретается (теряется) одной молекулой окислителя (восстановителя) в рассматриваемой окислительно-восстановительной реакции.
Пример 3. Сколько граммов FeSO4 можно окислить в присутствии H2SO4 с помощью 100 мл 0,25 н. раствора K2CrO4?
Решение. В 100 мл 0,25 н. раствораK2CrO4
содержится 0,025 моль-экв. окислителя;
0,025 моль-экв. окислителя могут окислить
0,025 моль-экв восстановителя. Так как
эквивалент восстановителя FeSO4
равен его молекулярной массе (Fe2+
– e
= Fe3+)
, т.е. 151,9, то искомая масса составит:
151.9 ∙ 0,025 = 3,8г FeSO4.
100 мл 0,25 н. раствораK2CrO4
содержится 0,025 моль-экв. окислителя;
0,025 моль-экв. окислителя могут окислить
0,025 моль-экв восстановителя. Так как
эквивалент восстановителя FeSO4
равен его молекулярной массе (Fe2+
– e
= Fe3+)
, т.е. 151,9, то искомая масса составит:
151.9 ∙ 0,025 = 3,8г FeSO4.
Вариант 1
1. Окислительно-восстановительные реакции выражаются ионными уравнениями:
Сг2O72- + 14Н+ + 6Cl– 3С12 + 2Сг3+ + 7Н2О;
2Fe3+ + S2- 2Fe2+ + S.
Составьте электронные и молекулярные уравнения. Для каждой реакции укажите, какой ион является окислителем, какой – восстановителем; какой ион окисляется, какой – восстанавливается.
2. Какая часть эквивалента содержится в 250 мл раствора FeSO4, содержащего 4 % FeSO4∙7H2O (ρ = 1,02 г/мл)?
Вариант 2
1. Реакции выражаются приведенными схемами:
Р + НIO3 + Н2O Н3РO4 + HI;
H2S + Сl2 + Н2O H2SO4 + НСl.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
2. Вычислите эквиваленты следующих восстановителей, исходя из их молекулярных масс: K2SO3, FeCO3, SnCl2, H3PO3.
