- •(ЧитГу)
- •Индивидуальные домашние задания по химии
- •1. Классы неорганических соединений
- •12,73 Г г раствора, тогда г
- •Вариант 2
- •Вариант 5
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •2. Химический эквивалент
- •Решение. Эквивалент есть количество вещества и выражается в молях.
- •Решение. Эквивалентную массу koh рассчитаем по формуле:
- •Решение. Эквивалент (эквивалентная масса) химического соединения равен сумме эквивалентов (эквивалентных масс) составляющих его частей.
- •3. Строение атома
- •Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 1
- •Вариант 5
- •Вариант 17
- •Вариант 18
- •5. Химическая термодинамика
- •Вариант 9
- •Вариант 1
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 18
- •11. Свойства металлов
- •Вариант 11
- •Вариант 21
- •Библиографический список
- •672039, Чита, ул. Александрово-Заводская, 30
Вариант 3
Составьте электронные формулы атомов элементов с порядковыми номерами 8 и 25. Какие электроны этих атомов являются валентными?
Какую низшую степень окисления проявляют сера и азот. Почему? Составьте формулы соединений кальция с атомами данных элементов в этой степени окисления и назовите их.
Рассчитайте среднюю массу и размер атома железа. ρFe = 7,8 г·см –3.
Вариант 4
Составьте электронные формулы атомов элементов с порядковыми номерами 13 и 22. К какому электронному семейству относится каждый из этих элементов?
Какие степени окисления может проявлять атом марганца? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соответствующих оксидов и гидроксидов.
Пылинка алюминия имеет массу 10 –8 г. Из какого числа атомов она состоит. ρAl = 2,7 г · см –3.
Вариант 5
Напишите электронно-графическую формулу атома серы в состоянии, предшествующем образованию ею соединения SF6.
Какие степени окисления может проявлять атом хрома. Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соединений, соответствующих этим степеням окисления, назовите их.
Рассчитайте среднюю массу атомов циркония и гафния.
Вариант 6
Составьте электронные формулы атомов элементов с порядковыми номерами 15 и 25. К какому электронному семейству относится каждый из этих элементов?
Какие степени окисления может проявлять атом селена? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соединений, соответствующих этим степеням окисления, назовите их.
Рассчитайте среднюю массу и размер атома кальция.
ρСa =1,54 г · см –3.
Вариант 7
Запишите электронные формулы атомов с зарядом ядра 9 и 20. Составьте графические схемы заполнения электронами валентных орбиталей этих атомов.
Какие степени окисления может проявлять атом титана? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соединений, соответствующих этим степеням окисления, назовите их.
Рассчитайте среднюю массу и размер атома кобальта. ρСо = 8,84 г · см –3.
Вариант 8
Определите положение атома элемента в периодической системе по его электронной формуле: 2s22p3; 3s23p5; 4s23d8.
Какие степени окисления может проявлять атом железа? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соответствующих оксидов и гидроксидов.
Из какого числа атомов состоят 2 г и 1 см 3 никеля.
ρNi = 8,9 г · см –3.
Вариант 9
Составьте электронные формулы атомов элементов с порядковыми номерами 11 и 22. К какому электронному семейству относится каждый из этих элементов?
Составьте формулы оксидов и гидроксидов атомов элементов третьего периода, отвечающие их высшей степени окисления. Как изменяются кислотно-основные свойства этих соединений?
Рассчитайте среднюю массу атомов цинка и кадмия.
Вариант 10
Определите положение атома элемента в периодической системе по его электронной формуле: 2s22p5; 3s23p2; 4s23d10.
Какие степени окисления может проявлять атом водорода? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соединений, соответствующих этим степеням окисления, назовите их.
Рассчитайте среднюю массу атомов натрия и цезия.
Вариант 11
Составьте электронные формулы атомов элементов с порядковыми номерами 17 и 25. К какому электронному семейству относится каждый из этих элементов?
Какие степени окисления может проявлять атом серы? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соединений, соответствующие этим степеням окисления, назовите их.
Рассчитайте среднюю массу и размер атома серебра.
ρAg=10,5 г ∙ см –3.
Вариант 12
Структура валентного электронного слоя атома выражается формулой: 2s22p4; 3s23p5; 3d54s1. Определите порядковый номер и название элемента.
Какие степени окисления может проявлять атом углерода? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соединений, соответствующих этим степеням окисления, назовите их.
3. Сколько атомов кальция содержится в 1 см 3, чему равна плотность
кальция, если мольный объем его Vмоль = 25,9 см 3 · моль–1.
Вариант 13
Составьте электронные формулы атомов элементов с порядковыми номерами 18 и 26. К какому электронному семейству относится каждый из этих элементов?
Какой из элементов 23V или 33As обладает более выраженными металлическими свойствами? Ответ мотивируйте, исходя из электронного строения атома. Напишите возможные формулы оксидов и гидридов этих элементов.
Рассчитайте среднюю массу и размер атома бериллия.
ρBe = 1,86 г ∙ см –3.
Вариант 14
Запишите электронные формулы атомов с зарядом ядра 16 и 22. Составьте графические схемы заполнения электронами валентных орбиталей этих атомов.
Сравните радиусы атомов и восстановительную способность: 20Ca и 38Sr; 20Ca и 30Zn. Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы оксидов и гидроксидов этих металлов.
Рассчитайте среднюю массу атомов серебра и золота.
Вариант 15
Электронная структура атома описывается формулой: а) 1s22s22p6; б) 1s22s22p63s23p63d34s2. Какой это элемент?
Какую низшую и высшую степень окисления проявляют атомы углерода и серы. Ответ мотивируйте, исходя из электронного строения атома. Составьте формулы соединений данных элементов, отвечающие этим степеням окисления.
Рассчитайте среднюю массу и размер атома циркония.
ρZr = 6,52 г · см –3.
Вариант 16
Составьте электронные формулы атомов элементов с порядковыми номерами 14 и 24. Какие электроны этих атомов являются валентными?
Сравните радиусы атомов и восстановительную способность: 19К и 29Cu; 19К и 37Rb. Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы оксидов и гидроксидов этих металлов.
Рассчитайте среднюю массу и размер атома олова. ρSn = 7,3 г · см –3.
Вариант 17
Атому какого из элементов отвечает каждая из приведенных электронных формул: 2s22p4; 3s23p6; 4s23d10? Напишите полную электронную формулу.
Какие степени окисления может проявлять атом хлора? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соединений, соответствующих этим степеням окисления, назовите их.
Сколько атомов кальция содержится в 1 г и в 2 см3? ρCa = 1,55 г · см –3.
Вариант 18
Составьте электронные и графические формулы атома 17Cl в нормальном и возбужденных состояниях.
Почему у элементов шестой группы хрома преобладают металлические свойства, а у селена – неметаллические? Ответ мотивируйте, исходя из электронного строения атома этих элементов. Напишите формулы высших оксидов элементов и соответствующих им гидроксидов.
Рассчитайте среднюю массу и размер атома висмута. ρBi = 9,84 г · см –3.
Вариант 19
Составьте электронные формулы атомов элементов с порядковыми номерами 20 и 30. Какие электроны этих атомов являются валентными?
Какие степени окисления может проявлять атом 33As? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соединений, соответствующие этим степеням окисления, назовите их.
Вычислите среднюю массу и размер атома титана. ρTi =4,49 г · см –3.
Вариант 20
Составьте электронные формулы атомов элементов с порядковыми номерами 11 и 16. Какие электроны этих атомов являются валентными? Составьте формулы соединений, в которых они проявляют высшую и низшую степени окисления.
Какую высшую и низшую степени окисления проявляют водород, фтор и кислород? Ответ мотивируйте, исходя из электронного строения атома. Составьте формулы соединений данных элементов, отвечающие этим степеням окисления.
Рассчитайте среднюю массу атомов олова и свинца.
Вариант 21
Атому какого из элементов отвечает каждая из приведенных электронных формул: 2s22p2; 3s23p6; 4s23d5? Напишите полную электронную формулу.
Какую высшую степень окисления проявляют 22Ti и 25Mn? Ответ мотивируйте, исходя из электронного строения атома. Составьте формулы оксидов и гидроксидов данных элементов, отвечающих этой степени окисления.
Рассчитайте среднюю массу и размер атома хрома. ρCr =7,2 г · см –3.
Вариант 22
Напишите электронные формулы атомов с зарядом ядра 19 и 21. Составьте графические схемы заполнения электронами валентных орбиталей этих атомов.
Какие степени окисления может проявлять атом 34Se? Ответ мотивируйте, исходя из электронного строения атома. Напишите формулы соединений, соответствующие этим степеням окисления, назовите их.
Сколько атомов содержится в 1 г титана? Каков радиус атома титана? Мольный объем титана Vмоль = 10,72 см 3 · моль–1.
Вариант 23
Назовите атомы элементов, имеющие по одному электрону на орбиталях 3p, 3d. Напишите их электронные формулы.
Составьте электронные и графические формулы атома 16S в нормальном и возбужденных состояниях. Как объясняет спиновая теория наличие у серы четной переменной валентности. Составьте формулы соединений серы, отвечающие этим валентностям.
Рассчитайте массу атома и плотность титана 4822Ti, если мольный объем его Vмоль = 10,72 см 3 · моль–1.
Вариант 24
Назовите элементы четвертого периода, атомы которых содержат максимальное число непарных электронов на d-орбиталях, p-орбиталях. Напишите их электронные формулы.
Составьте электронные и электронно-графические формулы атома 15P в нормальном и возбужденных состояниях. Составьте формулы соединений, в которых фосфор проявляет характерные для него степени окисления. Назовите соединения.
Рассчитайте среднюю массу и размер атома свинца.
ρPb = 6,62 г ·см –3.
Вариант 25
1. Напишите электронно-графическую формулу атома серы в состоянии, предшествующем образования ею соединения SF6.
2. Почему у элементов седьмой группы марганца преобладают металлические свойства, а у хлора – неметаллические? Ответ мотивируйте, исходя из электронного строения атома этих элементов. Напишите формулы высших оксидов элементов и соответствующих им гидроксидов.
Сколько атомов бериллия содержится в 1 см 3 и чему равна плотность бериллия, если мольный объем его Vмоль = 5 см 3 · моль–1.
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
Пример 1.
Дипольный
момент молекулы HCN
равен 0,9710-29
Клм.
Определите длину диполя молекулы
HCN.![]()
Решение. Полярность связи характеризуется величиной дипольного момента . Дипольный момент равен =е-l, где е-– заряд электрона (1,60210-19 Кл); l — длина диполя, м. Длина диполя l равна
![]()
Пример 2. Какой вид гибридизации электронных облаков имеет место в атоме кремния при образовании молекулы SiF4? Какова пространственная структура этой молекулы?
Решение. В возбужденном состоянии структура внешнего энергетического уровня атома кремния следующая:
|
|
|
|
|
|
3s |
3pх |
3pу |
3pz |
В образовании химических связей в атоме кремния участвуют электроны третьего энергетического уровня: один электрон в s-состоянии и три электрона в р-состоянии. При образовании молекулы SiF4 возникают четыре гибридных электронных облака (sp3-гибридизация). Молекула SiF4 имеет пространственную тетраэдрическую конфигурацию.
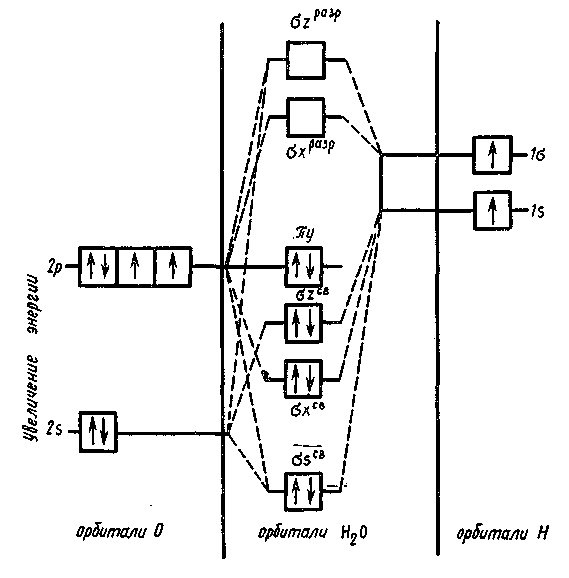
Пример 3. Опишите с помощью метода молекулярных орбиталей молекулу Н20.
Решение. В методе молекулярных орбиталей молекула рассматривается как единая система, содержащая ядра и электроны. При образовании молекулы возникают молекулярные орбитали двух видов –связывающие и разрыхляющие. Если при образовании молекулы из атомов переход электрона на молекулярную орбиталь будет сопровождаться уменьшением энергии, то такая молекулярная орбиталь является связывающей. В случае, если переход электрона на молекулярную орбиталь сопровождается увеличением энергии, то такая молекулярная орбиталь будет разрыхляющей.
Электроны в молекулах располагаются на -, - и -молекулярных орбиталях. -орбиталь может быть скомбинирована из s-атомных орбиталей, причем образуются молекулярные орбитали двух типов: связывающие (св) и разрыхляющие (разр):
св1s и разр1s (или св2s и разр2s),
-молекулярные орбитали могут быть образованы и перекрыванием 2pх-атомных орбиталей. При перекрывании 2pу – и 2pz-атомных орбиталей образуются у- и z_ молекулярные орбитали. Порядок размещения электронов по молекулярным орбиталям тот же, что и в случае атомных орбиталей: прежде всего заполняются орбитали с низкой энергией. Заполнение молекулярных орбиталей подчиняется принципу Паули (на каждой орбитали может быть не более двух электронов с противоположными спинами) и правилу Гунда.
В молекуле воды 8 валентных электронов, 6 от атома кислорода (2s22p4) и 2 от двух атомов водорода (1s).
Молекулярные орбитали воды образуются за счет перекрывания 2s- и 2p-орбиталей атома кислорода и 1s-орбиталей двух атомов водорода. Всего образуется 6 валентных молекулярных орбиталей (число молекулярных орбиталей во внешнем слое молекулы равно сумме валентных атомных орбиталей составляющих ее атомов).
При перекрывании 2рх_ орбитали атома кислорода и ls-орбиталей двух атомов водорода возникают две молекулярные орбитали: хсв и хразр. Перекрывание 2s- и 2pz-орбиталей атома кислорода с ls-орбиталями двух атомов водорода приводит к образованию еще трех молекулярных орбиталей: sсв и zразр и почти несвязывающей z. 2ру_ орбиталь атома кислорода не перекрывается с ls-орбиталями атомов водорода и поэтому является несвязывающей у- орбиталью.
Восемь валентных электронов в молекуле воды на молекулярных орбиталях располагаются следующим образом: Н2О [(sсв)2(хсв)2(z)2(у)2].
Пример 4. Определите тип гибридизации орбиталей центрального атома в частице Н3О+. Назовите и изобразите геометрическую форму этой частицы.
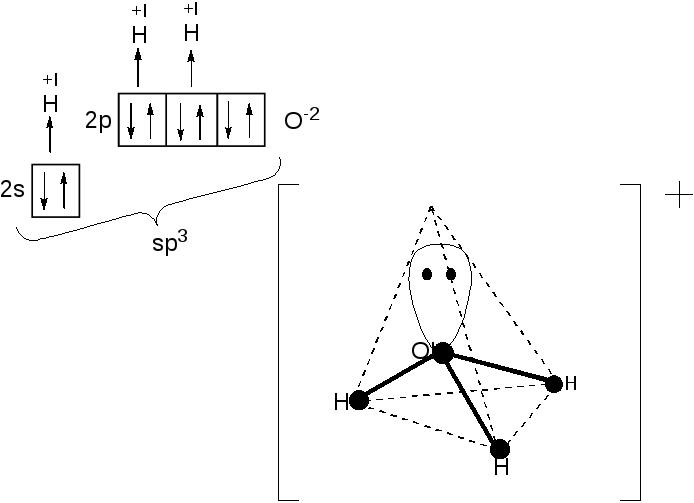
 Решение.
Решение.
![]()
![]()
![]()
![]()
(донор)
![]()
(акцептор)
3-связи
![]()

sp3-гибридиза-
ция, незавер-
шенный тетраэдр
Образование -связей между атомами А и В не влияет на геометрию молекул и в схеме не указывается, но должно быть учтено в пространственных изображениях частиц. Когда число , -связанных концевых атомов В (чаще других элементов-атомов кислорода) больше одного, то -связь изображается пунктиром. При наличии -связывания симметричность направленности химических связей не уменьшается.
Пример 5. Определите тип гибридизации орбиталей центрального атома в частице NO2. Назовите и изобразите геометрическую форму этой частицы.
Решение.
N+4+2O-2=NO2
N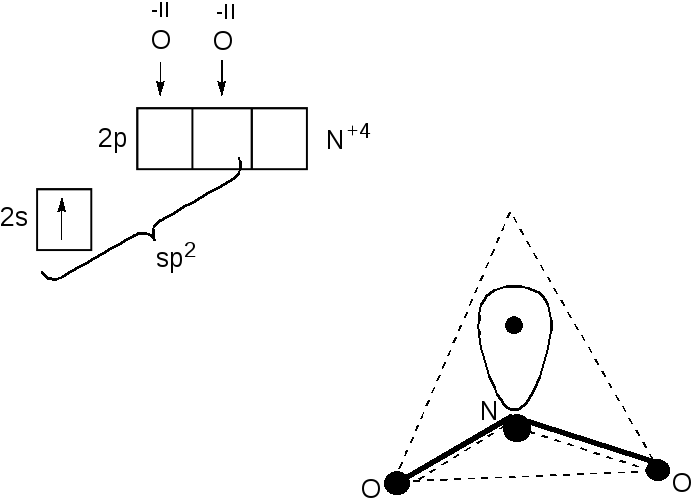
 +4=[2He]2s12p0
+4=[2He]2s12p0
(акцептор)
O-2==[2He]2s22p6(донор)
2,
-связи
![]()

sp2-гибридиза-
ция, незавер-
шенный треугольник