
- •Взаимосвязь процессов обмена углеводов, жиров и белков Методические указания
- •1 Распад (катаболизм) органических веществ 5
- •2 Биосинтез (анаболизм) органических веществ 26
- •Введение
- •Распад (катаболизм) органических веществ
- •Гидролитическое расщепление углеводов
- •Включение в путь гликолиза гексоз
- •Гликолиз
- •Анаэробная фаза превращения пвк – брожение
- •Аэробная фаза превращения пвк – дыхание
- •Гидролитическое расщепление липидов
- •Включение глицерина
- •Включение высших жирных кислот
- •Окисление ненасыщенных жирных кислот
- •Окисление жирных кислот с нечетным числом углеродных атомов
- •Гидролитическое расщепление белков
- •Катаболизм аминокислот
- •Биосинтез (анаболизм) органических веществ
- •Взаимосвязь липидов и углеводов
- •Синтез углеводов из жиров
- •Глиоксилатный цикл
- •Превращение янтарной кислоты в фосфоенолпировиноградную (феп)
- •Превращение феп в глюкозу. Глюконеогенез
- •3 Этап. Превращение глицерина в глюкозу.
- •Синтез жиров из углеводов
- •Синтез глицерол-3-фосфата
- •Взаимосвязь липидов и углеводов
- •Синтез жиров из углеводов
- •Синтез жирных кислот
- •Синтез триацилглицеролов
- •Взаимосвязь белкового и углеводного обменов
- •Взаимосвязь белкового и липидного обменов
- •Список использованной литературы
Гидролитическое расщепление белков
Главный, но возможно не единственный путь распада белков в организме – гидролиз. Гидролитический распад белков протекает в любой клетке организма в основном в специальных субклеточных элементах – лизосомах, где сосредоточены гидролитические ферменты и где осуществляется деструкция высокомолекулярных веществ до низкомолекулярных метаболитов.
Вместе с тем, определенная часть ферментов, ускоряющих распад белков, есть в цитоплазме клетки, а некоторые из них секретируются в желудочно-кишечном тракте, обеспечивая внеклеточное переваривание белков.
Гидролиз белков может быть частичным (до пептидов) и полным (до аминокислот). При частичном (неполном) гидролизе в белковой молекуле распадаются лишь некоторые пептидные связи, как правило, по соседству со строго определенными амнокислотными радикалами. Этот процесс ускоряется специфическими протеолитическими ферментами (протеиназы).
В свою очередь пептиды гидролизуются до аминокислот при участии ряда пептидаз.
Следовательно, ферментный аппарат пищеварительного тракта осуществляет поэтапное, строго избирательное расщепление пептидных связей белковой молекулы вплоть до конечных продуктов гидролиза белков – свободных амнокислот.
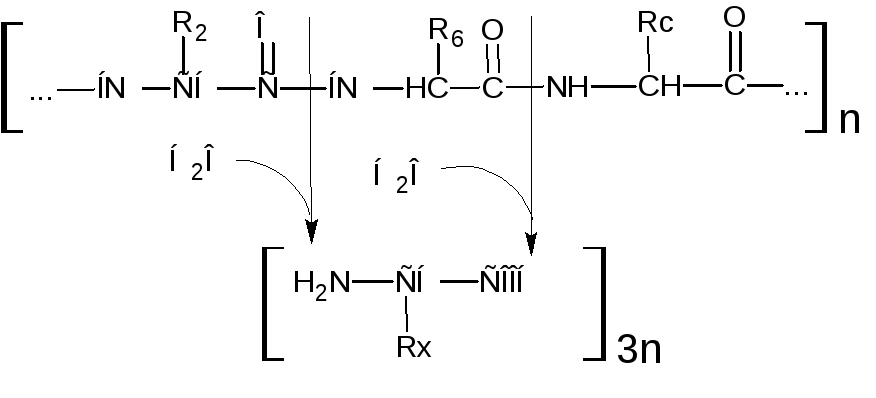
Свободные аминокислоты могут подвергаться дальнейшему распаду, включаясь в гликолиз или сразу же в цикл Кребса (рис. 2, Приложение А).
Катаболизм аминокислот
Первая реакция, которой подвергается аминокислота при катаболизме, это реакция освобождения от аминогруппы, которая может осуществляться либо путем переаминирования, либо дезаминирования. В реакции переаминирования участвуют все аминокислоты за исключением лизина. В результате этой реакции образуются -кетокислоты.
Для животных тканей, растений и большинства микрорганизмов преобладающим типом реакций является окислительное дезаминирование аминокислот, за исключением гистидина, подвергающегося внутримолекулярному дезаминированию.
Окислительное дезаминирование аминокислот приводит к образованию аммиака и углеродного скелета в форме -кетокислоты. Эта реакция идет в две ступени: в первой – аминокислота окисляется до иминокислоты:
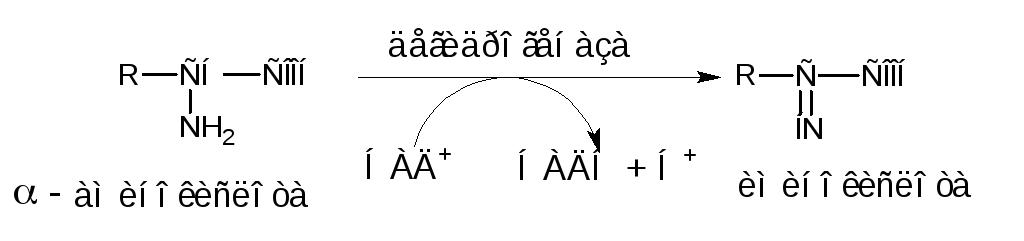
во второй – иминокислота превращается в кетокислоту:
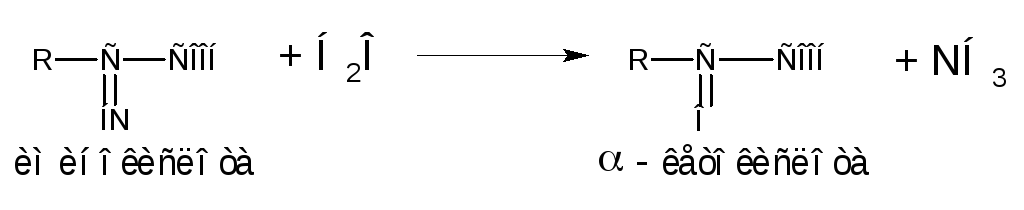
В результате окислительного дезаминирования образуются -аминокислоты, которые могут включаться в цикл Кребса через пируват, ацетил-КоА, оксалоацетат,-кетоглутарат и т.д.
Например, при окислительном дезаминировании аланина образуется пируват:
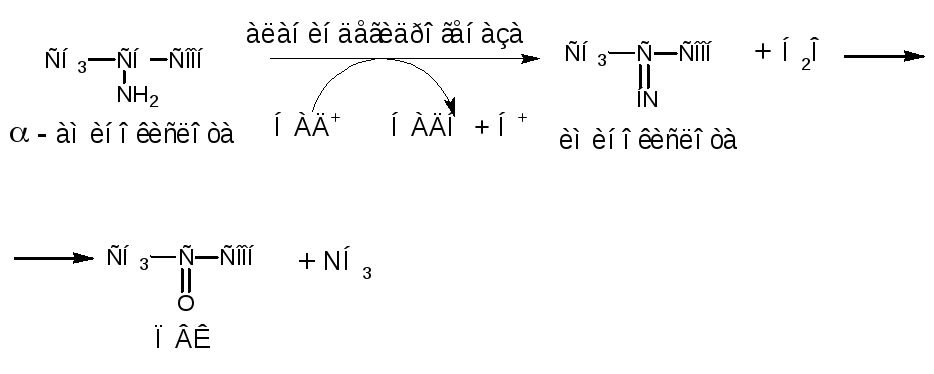
Пируват, как было сказано ранее, является главным конечным продуктом процесса гликолиза при катаболизме углеводов. Далее ПВК в результате окислительного декарбоксилирования (этап III) превращается в ацетил-КоА, который окисляется в цикле Кребса (рис. 2, Приложение А).
Включение остальных аминокислот можно представить в виде общей сводной схемы:
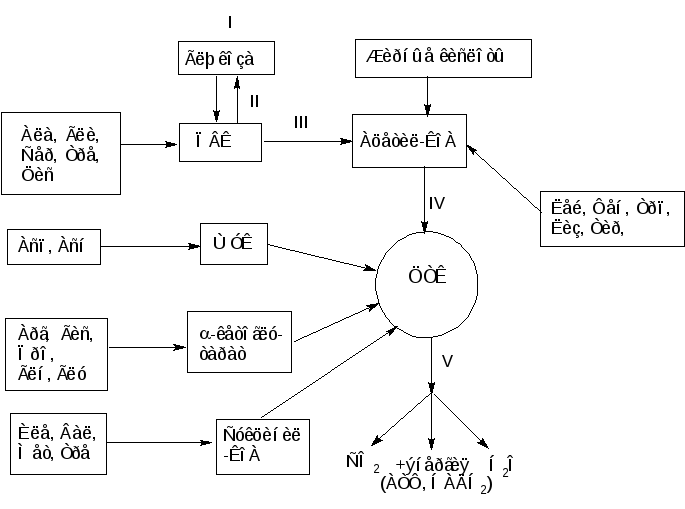
Рисунок 6 – Катаболизм аминокислот
Пять аминокислот (Фен, Лиз, Лей, Трп, Тир) считаются «кетогенными», поскольку они являются предшественниками кетоновых тел, в частности ацетоуксусной кислоты, в то время как большинство других аминокислот, обозначаемых как «гликогенные», служат в организме источником энергии, или углеводов, в частности глюкозы. Разделение аминокислот на «кетогенные» и «гликогенные» носит, однако, условный характер, поскольку отдельные участки углеродных атомов Лиз, Трп, Фен, Тир могут включаться и в молекулы предшественников глюкозы, например Фен и Тир – в фумарат. Истинно «кетогенной» аминокислотой является только Лейцин.
