
- •Федеральное агентство по образованию Волгоградский государственный архитектурно-строительный университет
- •Волгоград 2010
- •Введение
- •Правила по технике безопасности
- •Лабораторная работа «комплексные соединения»
- •1. Теоретическая часть
- •1.1. Общие сведения о комплексных соединениях
- •1.2. Природа химической связи в комплексных соединениях
- •1.3. Устойчивость комплексного иона
- •1.4. Номенклатура комплексных соединений
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «скорость химических реакций»
- •1. Теоретическая часть
- •1.1. Скорость гомогенных и гетерогенных реакций
- •1.2. Зависимость скорости химической реакции от концентрации
- •1.3. Зависимость скорости реакции от температуры
- •1. 4. Примеры решения задач
- •2. Экспериментальная часть
- •Контрольное задание
- •Контрольные вопросы
- •Лабораторная работа «катализ»
- •1. Теоретическая часть
- •1.1. Общие сведения о катализе
- •1.2. Гомогенный катализ
- •1.2. Гетерогенный катализ
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «химическое равновесие»
- •1. Теоретическая часть
- •1.1. Обратимые и необратимые реакции
- •1.2. Химическое равновесие и вывод константы равновесия
- •1.3. Смещение химического равновесия. Принцип Ле Шателье
- •1. 4. Примеры решения задач
- •2. Экспериментальная часть
- •Контрольное задание
- •Контрольные вопросы
- •Лабораторная работа «ионообменные реакции»
- •1. Теоретическая часть
- •1.1. Электролитическая диссоциация; сильные и слабые электролиты
- •1.2. Принципы протекания ионообменных реакций
- •1. 3. Примеры решения задач
- •2. Экспериментальная часть
- •Контрольное задание
- •1.2. Влияние одноименных ионов на растворимость и солевой эффект
- •1.3. Растворимость осаждаемого соединения и образование осадков
- •1. 4. Примеры решения задач
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Лабораторная работа «водородный показатель. Гидролиз солей»
- •1. Теоретическая часть
- •1.1. Диссоциация воды. Ионное произведение воды. Водородный показатель
- •1.2. Гидролиз солей
- •1.2. Степень гидролиза и константа гидролиза
- •1. 4. Примеры решения задач
- •2. Экспериментальная часть
- •Контрольные вопросы
- •Список рекомендуемой литературы
- •Дополнительная
- •400074, Волгоград, ул. Академическая, 1
2. Экспериментальная часть
Содержание работы:
1. После ознакомления с теоретическим материалом выполнить опыты и записать результаты наблюдений и уравнения реакций.
2. На основании экспериментальных данных по каждому опыту сделать выводы о зависимости процессов образования осадков или их растворения от значений произведений растворимости соответствующих малорастворимых соединений.
Опыт 1. Образование осадков галогенидов свинца
Налить в первую пробирку равные объемы 0,1М растворов Pb(NO3)2 и NaCl. Получится ли осадок? Почему? Произвести расчет по формуле ПР для образующегося осадка (оставить пробирку для опыта 3). Во вторую пробирку налить равные объемы 0,1М растворов Pb(NO3)2 и KI. Получится ли осадок? Почему? Произвести расчет по формуле ПР. В третью пробирку налить равные объемы 0,1М раствора Pb(NO3)2 и 1М раствора NaCl. Получится ли осадок? Почему? Произвести расчет по формуле ПР. Во всех случаях записать уравнения реакций.
Опыт 2. Исследование влияния осадителя на полноту осаждения иона свинца из раствора
а) Смешать в колбе 10 мл 1М раствора Pb(NO3)2 с 10 мл 1М раствора NaCl. Закрыть пробкой и энергично взболтать колбу, отфильтровать образовавшийся осадок PbCl2 на фильтровальной бумаге. Испытать фильтрат (отфильтрованную жидкость) на полноту осаждения PbCl2, прибавив к нему 1-2 капли 1М раствора NaCl. Фильтрат разделить на 2 части. К одной из них добавить немного 1М раствора Na2SO4, к другой 1М раствора Na2S. Записать наблюдения. Написать уравнения реакций и объяснить наблюдения.
б) К 5 мл 1М раствора Pb(NO3)2 прибавить 5 мл 1М раствора Na2SO4. Отфильтровать осадок и прибавить к фильтрату немного 1М раствора Na2S. Записать наблюдения и объяснить их, основываясь на значениях ПР солей свинца.
Опыт 3. Влияние общего иона на растворимость соли свинца
В сохраненную в первом опыте пробирку с PbCl2 добавить несколько капель насыщенного раствора NaCl. Записать наблюдения и объяснить их, основываясь на значениях ПР соли.
Опыт 4. Влияние значений ПР солей на растворение их осадков
Прилить в первую пробирку 1-2 мл 1М раствора FeSO4 и столько же 1М раствора Na2S. Во вторую пробирку прилить 1-2 мл 1М раствора CuSO4 и добавить столько же 1М раствора Na2S. Записать наблюдения. Написать уравнения реакций.
К осадку FeS и к осадку CuS прилить немного 1М HCl. Записать наблюдения. Написать уравнения реакций.
Сделать вывод о влиянии величины ПР на растворение осадков солей.
Опыт 5. Влияние общего иона на растворимость NaCl в воде
Налить в химический стакан 10 мл насыщенного раствора NaCl и добавить к нему по каплям концентрированный раствор HCl. В другой химический стакан налить 10 мл насыщенного раствора NaCl и добавить к нему по каплям концентрированный раствор щелочи NaOH. Записать наблюдения и объяснить наблюдаемые явления.
Контрольные вопросы
Вывести уравнение ПР для CaCO3 и вычислить числовую величину
 ,
зная, что растворимостьCaCO3
равна 0,0069 г/л. Ответ:
,
зная, что растворимостьCaCO3
равна 0,0069 г/л. Ответ:
 .
.Растворимость Fe(OH)3 равна
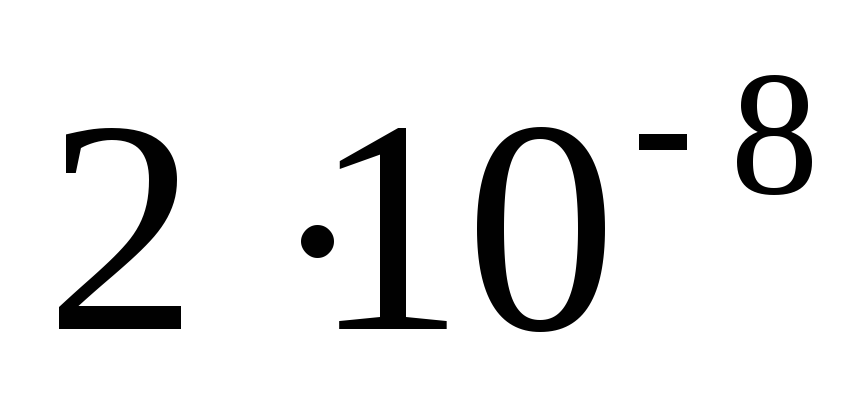 г/л. Определить
г/л. Определить .
Ответ:
.
Ответ: .
.По растворимости CuSO4 , равной 2 г/л, вычислить
 .
Вычисления произвести с учетом
коэффициентов активности ионов. Ответ:
.
Вычисления произвести с учетом
коэффициентов активности ионов. Ответ: .
.По произведениям растворимости PbSO4 и PbI2 вычислите их растворимость в моль/л и г/л. Почему соль с меньшим значением ПР имеет большую растворимость? Ответ: PbSO4
 моль/л;
моль/л; г/лPbI2
г/лPbI2
 моль/л;
моль/л; г/л.
г/л.По произведению растворимости Pb3(PO4)2 равному
 ,
вычислить растворимость этой соли в
г/л и моль/л. Определить концентрации
ионовPb+2
и PO43–
в насыщенном растворе соли. Ответ:
,
вычислить растворимость этой соли в
г/л и моль/л. Определить концентрации
ионовPb+2
и PO43–
в насыщенном растворе соли. Ответ:
 г/л;
[Pb2+]
=
г/л;
[Pb2+]
=
 моль/л,
[PO43–]
=
моль/л,
[PO43–]
=
 моль/л.
моль/л.По
 ,
равному
,
равному ,
найти растворимость этой соли в г/л (с
учетом коэффициентов активности ионов).
,
найти растворимость этой соли в г/л (с
учетом коэффициентов активности ионов).
Ответ:
![]() моль/л;
1,91 г/л.
моль/л;
1,91 г/л.
Как ненасыщенный раствор AgBrO3 сделать насыщенным и пересыщенным при той же температуре?
Как влияет на растворимость трудно растворимых электролитов введение в раствор одноименных ионов?
Во сколько раз меньше растворимость AgCl в 0,01М растворе NaCl по сравнению с растворимостью в чистой воде. Ответ: приблизительно в 800 раз.
Что такое солевой эффект? Как он объясняется на основании теории сильных электролитов?
Исходя из правила ПР, сформулируйте:1) условие образование осадка; 2) условие растворения осадков.
Вычислите, образуется ли осадок PbCl2 при смешении 0,05Н раствора Pb(NO3)2 с равным объемом: а) 0,05Н раствора HCl; б) 0,5Н раствора HCl. Ответ: а) не образуется; б) образуется.
