
- •Глава 1. Атомно-кристаллическое строение материалов
- •1. Электронное строение атомов. Классификация элементов в периодической системе д. И. Менделеева
- •2. Кристаллическое строение твердых тел
- •3. Типы связей между атомами (молекулами) в кристаллах
- •Пояснения к ответам на вопросы
- •2) Правильно.
- •Глава II. Основы теории кристаллизации
- •1. Энергетические условия кристаллизации
- •2. Механизм процесса кристаллизации
- •3. Размер зерна, образующегося при кристаллизации. Строение кристаллического слитка
- •4. Дефекты строения реальных металлов
- •5. Полиморфные превращения металлов
- •6. Методы изучения кристаллического строения металлов
- •Пояснения к ответам на вопросы
- •Глава III. Механические свойства металлов
- •1. Свойства, определяемые при статических испытаниях.
- •2. Свойства, определяемые при динамическом нагружении
- •3. Свойства, определяемые при циклически действующих нагрузках (усталость материалов)
- •4. Свойства, определяемые нагружением в условиях повышенных температур
- •Глава IV. Физическая сущность механизмов деформации и разрушения металлов
- •1. Механизм упругой и пластической деформации металлов
- •3. Факторы, влияющие на хрупкое и вязкое состояние металлов
- •4. Основные направления повышения прочности металлов. Конструктивная прочность
- •Глава V. Наклеп, возврат и рекристаллизация металлов и сплавов
- •1. Наклеп металла
- •2. Отдых (возврат) металла
- •3. Рекристаллизация
- •4. Полигонизация
- •1). Совершенно правильно.
- •3). Ошибаетесь.
- •3). Совершенно правильно.
- •1). Ответ неточный.
- •2). Совершенно правильно.
- •1). Ответ неполный.
- •2). Совершенно правильно.
- •3). Правильно.
- •Глава VI. Строение и свойства сплавов
- •1. Металлические сплавы
- •Характеристика основных фаз в сплавах
- •Особенности кристаллизации сплавов
- •2. Диаграммы состояния сплавов
- •3). Совершенно правильно.
- •2). Правильно.
- •3). Совершенно правильно.
- •2). Правильно.
- •2). Совершенно правильно.
- •3). Правильно.
- •3). Правильно.
- •1). Правильно.
- •3). Правильно.
- •Глава VII. Сталь и чугун
- •1. Диаграмма состояния Fe—Fe3c
- •Глава VIII. Углеродистые стали
- •1. Влияние состава на свойства стали
- •2. Технологические свойства стали
- •3. Основы легирования стали
- •4. Фазы, образуемые легирующими элементами с железом. Влияние легирующих элементов на температуру полиморфных превращений железа.
- •Карбидообразующие легирующие элементы и типы образуемых карбидов
- •5. Влияние легирующих элементов на содержание углерода в перлите, температуру эвтектоидного превращения и свойства стали
- •6. Классификация и маркировка сталей
- •Глава IX. Чугуны
- •1. Процесс графитизации чугунов
- •2. Серый чугун
- •3. Высокопрочный чугун с шаровидным графитом
- •4. Ковкий чугун
- •Марки, основные механические свойства и структуры серых, ковких и высокопрочных чугунов (выборка)
1. Энергетические условия кристаллизации
 На
рис. 12 показано изменение изобарного
потенциала G
с
температурой для жидкой Gж
и
твердой GТ
фаз. Процесс кристаллизации развивается,
если температура ниже Ts,
например Tk.
Разность между теоретической температурой
кристаллизации Ts
и
реальной температурой
Th,
при
которой протекает кристаллизация,
называется
степенью
переохлаждения системы n=Ts-Tk.
На
рис. 12 показано изменение изобарного
потенциала G
с
температурой для жидкой Gж
и
твердой GТ
фаз. Процесс кристаллизации развивается,
если температура ниже Ts,
например Tk.
Разность между теоретической температурой
кристаллизации Ts
и
реальной температурой
Th,
при
которой протекает кристаллизация,
называется
степенью
переохлаждения системы n=Ts-Tk.
Влияние скорость охлаждения на величину переохлаждения демонстрирует рис. 13. На графике представлены термические кривые процесса кристаллизации чистого металла при охлаждении со скоростями V1<V2<V3. Верхние участки кривых охлаждения показывают понижение температуры жидкого металла; при температуре горизонтальных участков происходит процесс кристаллизации. Выделение скрытой теплоты кристаллизации способствует сохранению постоянной температуры в течение процесса кристаллизации. Нижние участки кривых соответствуют охлаждению закристаллизовавшегося металла.
Пунктирной линией на диаграмме показано значение теоретической температуры кристаллизации Ts. Видно, что с увеличением скорости охлаждения V степень переохлаждения n увеличивается. Однако металлы склонны к небольшому переохлаждению. Величина n для них составляет несколько градусов и в редких случаях несколько десятков градусов (для Sb n=41°С). Органические вещества при кристаллизации часто склонны к весьма значительным переохлаждениям.
№ 26. Каков физический смысл температуры TS соответствующий точке пересечения кривых GT и Gm на рис. 12? Ответ (см. на с. 29): при Ts 1) начинается кристаллизация; 2) происходит плавление; 3) в равновесии находятся жидкая и твердая фазы.
2. Механизм процесса кристаллизации
Интуитивно кажется, что при кристаллизации должны протекать существенные структурные изменения, приводящие к некоторому регулярному расположению в пространстве атомов вещества, свойственному кристаллическому телу. Экспериментально установлено, что между кристаллическим и жидким состояниями, особенно при температурах, близких к температуре кристаллизации, существует много общего:
природа сил связей между атомами в жидком и твердом состояниях одна и та же;
теплоемкость тел в твердом и жидком состояниях мало различаются, в связи с чем Я.И. Френкель сформулировал важное положение, что «тепловое движение частиц в жидком состоянии имеет тот же характер малых колебаний около средних равновесных положений, как и в случае твердых тел»;
рентгенограммы жидких металлов демонстрируют наличие определенных линий, хотя и размытых, что также говорит об упорядочном расположении атомов в жидкой фазе.
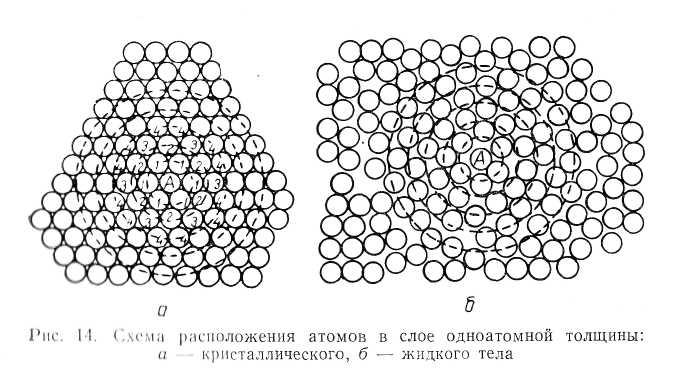 На
рис. 14 представлены схемы расположения
атомов в слое одноатомной толщины
кристаллического (а)
и жидкого (б)
тела. Из центра атома А,
рис.
14 проведены ряд окружностей через центры
атомов, ближайших к нему. В случае
кристаллической укладки (а)
атомов видно наличие порядка в расположении
их как вблизи атома А,
так
и вдали от пего. Это значит, что для
кристаллического тела характерно
наличие как ближнего, так и дальнего
порядка в упаковке атомов.
На
рис. 14 представлены схемы расположения
атомов в слое одноатомной толщины
кристаллического (а)
и жидкого (б)
тела. Из центра атома А,
рис.
14 проведены ряд окружностей через центры
атомов, ближайших к нему. В случае
кристаллической укладки (а)
атомов видно наличие порядка в расположении
их как вблизи атома А,
так
и вдали от пего. Это значит, что для
кристаллического тела характерно
наличие как ближнего, так и дальнего
порядка в упаковке атомов.
В случае жидкости (рис. 14б) можно видеть, что на первой окружности имеется тоже 6 атомов, центры которых близко расположены от окружности, однако на более далеких окружностях порядок все больше нарушается. Из этого можно заключить, что для жидкости характерно наличие только ближнего — и отсутствие дальнего порядка.
В отличие от кристаллического состояния, которое является относительно стабильным, регулярные комбинации атомов в жидком состоянии весьма недолговечны — нарушаются в одних и возникают в других участках.
№ 27. В чем принципиальное отличие жидкого состояния от кристаллического? Ответ (см. на с. 29): 1) в меньшем порядке расположения атомов в жидкости; 2) в меньшем порядке и меньшей стабильности расположения атомов в жидкости; 3) в меньшей стабильности расположения атомов в жидком состоянии.
Еще Д.К. Чернов высказал положение, что механизм кристаллизация заключается в образовании центров (зародышей) кристаллизации ч.ц. в жидкой фазе и в росте этих центров. Можно представить, что в жидкости могут возникать атомные группировки, взаимное расположение атомов в которых соответствует положению атомов в кристалле. Очевидно, такие образования могут рассматриваться как центры кристаллизации, которые при благоприятных температурных условиях (T<сTs) (рис. 12) будут обрастать атомами и превращаться в кристаллы.
Однако, не каждое такое образование даже, когда GT < Gж, т. е. при Т<Тс, (рис. 12) является устойчивым и способным к росту. Центрами кристаллизации являются такие образования, рост которых сопровождается уменьшением изобарного потенциала системы.
Каждой
степени переохлаждения n
соответствует
критический размер зародыша rk,
рост
которого термодинамически выгоден.
Рост зародышей с размерами меньше rk
сопровождался
бы ростом (см. рис. 15) G
системы, что невозможно. Общее изменение
изобарного потенциала G
при кристаллизации складывается из
двух составляющих G
и
GS,
т.е. G=G+GS,
где G
- уменьшение потенциала за счет
образования твердой фазы объемом v,
т.е.
GV<0.
GS
- приращение потенциала из-за образования
поверхности раздела твердой и жидкой
фазами, в которой действует поверхностное
натяжение ,
т.е.
GS
>
0. Если общая поверхность раздела фаз
S,
то GS=S.
Эмпирическая
зависимость между rk,
и
DG
![]() ,
что полностью подтверждает высказанную
гипотезу.
,
что полностью подтверждает высказанную
гипотезу.
Тогда
уравнение энергетического баланса
кристаллизующейся системы:
![]() .
Отсюда следует, что процесс кристаллизации
должен протекать тем интенсивней, чем
больше степень переохлаждения и меньше
коэффициент поверхностного натяжения.
.
Отсюда следует, что процесс кристаллизации
должен протекать тем интенсивней, чем
больше степень переохлаждения и меньше
коэффициент поверхностного натяжения.
№ 28.
Принимая зародыши кристаллизации за
сферу радиусом r
и
удельную поверхностную энергию кристаллов
за ,
докажите,
что
![]() .Используйте
рис. 15 и известные Вам из курса высшей
математики способы. В случае затруднения
посмотрите разъяснение на с. 30.
.Используйте
рис. 15 и известные Вам из курса высшей
математики способы. В случае затруднения
посмотрите разъяснение на с. 30.
Н а
рис. 16 приведена кривая зависимости
числа центров кристаллизациич.
ц. от
степени переохлаждения п.
Пунктирная
часть кривой ч.ц.
на
рис. 16 при кристаллизации металлов не
реализуется.
а
рис. 16 приведена кривая зависимости
числа центров кристаллизациич.
ц. от
степени переохлаждения п.
Пунктирная
часть кривой ч.ц.
на
рис. 16 при кристаллизации металлов не
реализуется.
Рассмотрим теперь другую часть механизма процесса кристаллизации — рост кристаллов. Рост кристаллов осуществляется образованием на гранях кристалла двухмерных зародышей, рис. 17б, минимальная величина которых уменьшается с увеличением степени переохлаждения. На рис. 17в представлена схема процесса кристаллизации, когда на верхней грани имеется ступенька, на которой удерживаются атомы из жидкости.
При такой ступеньке происходит спиралевидный рост кристалла (рис. 17г). Кривая скорости роста кристалла с.p. (рис. 16) имеет такую же форму, что к и кривая ч.ц. Только максимум кривой с.р. сдвинут к более высоким значениям переохлаждения n. Для металлов реализуется лишь восходящая часть кривой с.р.
М ногие
неметаллические материалы с крупными
частицами, молекулами,
(стекло,
полимеры, смолы) склонны к очень большим
переохлаждениям. Они постепенно теряют
жидкотекучесть, твердеют, не приобретая
кристаллического строения. Такие тела
называются аморфными.
ногие
неметаллические материалы с крупными
частицами, молекулами,
(стекло,
полимеры, смолы) склонны к очень большим
переохлаждениям. Они постепенно теряют
жидкотекучесть, твердеют, не приобретая
кристаллического строения. Такие тела
называются аморфными.
№ 29. В чем должно быть принципиальное различие кривой охлаждения аморфного и кристаллического тел. Ответ (см. на 30): 1) в форме кривых охлаждений; 2) в характере изменения температуры во времени; 3) на кривой охлаждения аморфного тела нет площадки.
№ 30. Как изменяется скорость кристаллизации металла при росте степени переохлаждения n1n2n3 (рис. 16)? Ответ (см. на с. 30): скорость кристаллизации 1) увеличивается; 2) не зависит от величины n; 3) увеличивается от n1 к n2, а степень переохлаждения n3 для металлов невозможна.
На рис. 18 приведена схема процесса кристаллизации, где светлый квадратик - центр кристаллизации или выросший к соответствующему моменту наблюдения кристалл. При росте кристаллов они сталкиваются друг с другом, теряют правильную форму и образуют поликристаллический агрегат, кристаллы в котором называются кристаллитами или зернами.
При изучении процесса кристаллизации исследуют зависимость количества закристаллизовавшегося вещества от времени при данной степени переохлаждения n=Ts-Тh. На основе полученных результатов строят кинетические кривые кристаллизации (рис. 19, А). Из рисунка видно, что при данной степени переохлаждения началу кристаллизации предшествует инкубационный период, когда кристаллизация идет очень медленно.
После
инкубационного периода кристаллизация
идет с возрастающей интенсивностью, и
после достижения определенного максимума
скорость процесса снова уменьшается.
Время инкубационного периода и общая
длительность процесса зависят от степени
переохлаждения n.
Для
металлов кинетические кривые с увеличением
степени переохлаждения сдвигаются
влево (рис. 19, А,
а).
Так
для свинца по данным И.Н. Богачева при
n=3°С
превращение начинается через 15 минут
и заканчивается через 35 минут; при
переохлаждении n=15°С
превращение начинается через 3 минуты
и заканчивается через 7 минут. Более
глубокое переохлаждение свинца приводит
к практически мгновенной кристаллизации.
Подобная картина имеет мес то
и для других металлов.
то
и для других металлов.
Для неметаллических материалов (рис. 19, A, б) при значительных переохлаждениях (n4, n5) кинетические кривые кристаллизации (T4 и T5) сдвигаются вправо, т.е. с увеличением степени переохлаждения n>n3 такие материалы обнаруживают увеличение инкубационного периода и общего времени кристаллизации тем больше, чем больше степень переохлаждения.
На основе кинетических кривых кристаллизации строят сводные диаграммы кинетики кристаллизации в координатах степень переохлаждения — время. На рис. 19, Б, а показана такая диаграмма для свинца, типичная для металлов. На рис. 19. Б, б приведена диаграмма кристаллизации для салола, типичная для кристаллизации неметаллических материалов.
№ 31. Что определяющим образом влияет на скорость кристаллизации? Ответ (см. на с. 30): 1) величина DG=Gж- GT; 2) значение GT; 3) факторы, влияющие на интенсивность образования центров и скорость роста кристаллов.
