
- •Предмет и задачи атомной физики, её место среди других физических наук.
- •Сериальные закономерности в атомных спектрах, комбинационный принцип Ритца, термы.
- •Класическая модель атома Томсана.
- •Основы классической теории электромагнитного излучения.
- •Опыты Резерфорда.
- •Вывод формулы Резерфорда для рассеяния α-частиц.
- •Следствия из опытов Резерфорда.
- •Экспериментальное определение заряда ядра по методу Чедвика.
- •Планетарная модель атома Резерфорда.
- •Столкновение частиц
- •Сечение рассеяния
- •Теория Бора для атома водорода, круговые орбиты.
- •Доказательство существования дискретной структуры энергетических уровней атомов.
- •Опыты Франка и Герца
- •Изотопический сдвиг
- •Ридберговские системы
- •Корпускулярно волновой дуализм
- •Гипотеза де Бройля и ее экспериментальное подтверждение на примере дифракции электронов, атомов, нейтронов
- •Фазовая и групповая скорости волн де Бройля.
- •Волновой пакет. Статистический характер связи корпускулярных и волновых свойств.
- •Электронный микроскоп, понятие об электронной оптике.
- •Основы квантовой механики.
- •Соотношение неопределённостей.
- •Волновая функция.
- •Принцип суперпозиции.
- •Уравнение Клейна-Гордона.
- •Нестационарное и стационарное уравнение Шрёдингера.
- •Частица в потенциальном ящике.
- •Спектры атомов щелочных металлов.
- •Серии в спектрах щелочных металлов и их происхождение.
- •Закон Мозли
- •Тонкая структура Спектральных линий атомов щелочных металлов.
- •Спин Электрона
- •Принцип Паули и заполнение электронных оболочек атомов
- •Физические основы периодической системы элементов таблицы Менделеева
- •Магнитные свойства Атомов
- •Орбитальный и собственный момент электрона
- •Полный магнитный момент одноэлектронного атома
- •Гиромагнитное отношение орбитальных моментов
- •Магнитная энергия атомов
- •Опыты Штерна и Герлаха
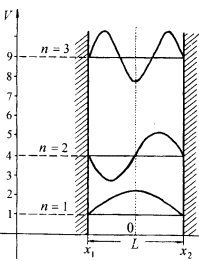
Частица в потенциальном ящике.
Задача о нахождении решений стационарного
уравнения Шрёдингера
![]() ,
когдаV(x)
равен нулю при
,
когдаV(x)
равен нулю при![]() и обращается в бесконечность вне этого
отрезка – это и есть задача о потенциальном
ящике с бесконечно высокими стенками.
Пусть для простых
и обращается в бесконечность вне этого
отрезка – это и есть задача о потенциальном
ящике с бесконечно высокими стенками.
Пусть для простых![]() ,
,![]() ,
гдеL– некоторая постоянная,
определяющая «длину» ящика. В областях
,
гдеL– некоторая постоянная,
определяющая «длину» ящика. В областях![]() и
и![]() ,
волновая функция равна нулю. В самом же
ящике, коль скоро
,
волновая функция равна нулю. В самом же
ящике, коль скоро![]() ,
уравнение Шрёдингера принимает вид
,
уравнение Шрёдингера принимает вид![]() .
Это дифференциальное уравнение второго
порядка имеет в качестве решения при
заданномEдве функции:
.
Это дифференциальное уравнение второго
порядка имеет в качестве решения при
заданномEдве функции:![]() и
и![]() ,
где
,
где![]() .
Общее решение будет иметь вид линейной
комбинации частных решений с двумя
произвольными постояннымиAиB:
.
Общее решение будет иметь вид линейной
комбинации частных решений с двумя
произвольными постояннымиAиB:![]() .
Полученное решение должно удовлетворять
двум граничным условиям
.
Полученное решение должно удовлетворять
двум граничным условиям![]() ,
т. е.
,
т. е.![]() и
и![]() .
Учитывая далее, что
.
Учитывая далее, что![]() и
и![]() ,
из этих двух уравнений нетрудно получить
,
из этих двух уравнений нетрудно получить![]() .
Пусть
.
Пусть![]() ,
получаем
,
получаем![]() ,
так что
,
так что![]() или, вспоминая, что
или, вспоминая, что![]() ,
получаем допустимы лишь определённые,
дескретные значения энергии:
,
получаем допустимы лишь определённые,
дескретные значения энергии:![]() ,
,![]()
Тема
Тема
Спектры атомов щелочных металлов.
В атомах щелочных металлов Li, Na, K, Rb, Cs и Fr на внешней орбите находится один валентный электрон, ответственный за образование спектра. Все остальные электроны расположены на внутренних замкнутых оболочках. В отличие от водородного атома, у атомов щелочных металлов поле, в котором движется внешний электрон, не является полем точечного заряда: внутренние электроны экранируют ядро. Степень экранирования зависит от характера орбитального движения внешнего электрона и его расстояния от ядра. Экранирование наиболее эффективно при больших значениях l и наименее эффективно для s-состояний, где электрон находится ближе всего к ядру. При больших n и l система энергетических уровней подобна водородной. Тонкая структура уровней у атомов щелочных металлов также подобна водородной. Каждое электронное состояние расщепляется на две близкие компоненты. Разрешенные переходы в обоих случаях определяются одинаковыми правилами отбора. Поэтому спектры атомов щелочных металлов подобны спектру атомарного водорода. Однако у щелочных металлов расщепление спектральных линий при малых п больше, чем у водорода, и быстро растет с увеличением Z.
Серии в спектрах щелочных металлов и их происхождение.
Поскольку при переходах главное квантовое число n может изменяться на любое значение, допустимы переходы в состояние 2 s из любых р-состояний. Получающаяся в результате этих переходов серия линий называется главной. Ее частоты условно обозначены в виде ω = 2s – mp (m = 2,3,4,...),
В спектре атома лития имеются кроме главной и другие серии. Важнейшие из них следующие. Первая побочная (или диффузная) серия. Частоты этой серии ω = 2p-md (m = 3, 4, 5,...). Серия называется диффузной потому, что ее линии несколько размыты, не очень резки.
Вторая побочная (или резкая) серия. Частоты этой серии ω = 2p-ms (m = 3, 4, 5,...).
Следующая серия, получающаяся в результате переходов электрона из f-состояний в 3 d-состояние, лежит в инфракрасной части спектра.
Закон Мозли
Мозли экспериментально установил закон,
согласно которому частота
![]()
![]() - линий зависит от атомного номера Z
элемента как
- линий зависит от атомного номера Z
элемента как![]() ,
,
Где R – постоянная Ридберга,
![]() - постоянная практически равная единице
для легких элементов. Этот закон сыграл
в свое время важную роль при уточнении
расположения элементов в периодической
системе.
- постоянная практически равная единице
для легких элементов. Этот закон сыграл
в свое время важную роль при уточнении
расположения элементов в периодической
системе.
Закон Мозли достаточно точно выполняется
для легких элементов. Для тяжелых же
поправка
![]() значительно отличается.
значительно отличается.
