
- •Предмет и задачи атомной физики, её место среди других физических наук.
- •Сериальные закономерности в атомных спектрах, комбинационный принцип Ритца, термы.
- •Класическая модель атома Томсана.
- •Основы классической теории электромагнитного излучения.
- •Опыты Резерфорда.
- •Вывод формулы Резерфорда для рассеяния α-частиц.
- •Следствия из опытов Резерфорда.
- •Экспериментальное определение заряда ядра по методу Чедвика.
- •Планетарная модель атома Резерфорда.
- •Столкновение частиц
- •Сечение рассеяния
- •Теория Бора для атома водорода, круговые орбиты.
- •Доказательство существования дискретной структуры энергетических уровней атомов.
- •Опыты Франка и Герца
- •Изотопический сдвиг
- •Ридберговские системы
- •Корпускулярно волновой дуализм
- •Гипотеза де Бройля и ее экспериментальное подтверждение на примере дифракции электронов, атомов, нейтронов
- •Фазовая и групповая скорости волн де Бройля.
- •Волновой пакет. Статистический характер связи корпускулярных и волновых свойств.
- •Электронный микроскоп, понятие об электронной оптике.
- •Основы квантовой механики.
- •Соотношение неопределённостей.
- •Волновая функция.
- •Принцип суперпозиции.
- •Уравнение Клейна-Гордона.
- •Нестационарное и стационарное уравнение Шрёдингера.
- •Частица в потенциальном ящике.
- •Спектры атомов щелочных металлов.
- •Серии в спектрах щелочных металлов и их происхождение.
- •Закон Мозли
- •Тонкая структура Спектральных линий атомов щелочных металлов.
- •Спин Электрона
- •Принцип Паули и заполнение электронных оболочек атомов
- •Физические основы периодической системы элементов таблицы Менделеева
- •Магнитные свойства Атомов
- •Орбитальный и собственный момент электрона
- •Полный магнитный момент одноэлектронного атома
- •Гиромагнитное отношение орбитальных моментов
- •Магнитная энергия атомов
- •Опыты Штерна и Герлаха
Столкновение частиц
В опытах Резерфорда применялись очень
тонкие металлические фольги с толщиной
порядка 10![]() -10
-10![]() см. В таких случаях при рассеянии на
большие углы можно было не учитывать
многократные столкновения α-частицы с
атомными ядрами. Вероятность двукратных,
а тем более многократных столкновений
с большими отклонениями ничтожна.
Ничтожна вероятность рассеяния на
большие углы и на электронах ввиду
малости их масс. Многократные столкновения
с ядрами и с электронами атомных оболочек
играют роль только при очень малых углах
рассеяния. Такие углы мы исключим из
рассмотрения. Тогда, учитывая взаимодействие
α-частицы только с одним ядром, к которому
α-частица подходит наиболее близко, мы
придем к задаче двух тел. От всех остальных
ядер α-частица проходит много дальше,
и поэтому взаимодействием с ними
пренебрегается. Таким образом, теория
Резерфорда применима для больших
отклонений, когда отклонение вызывается
только электрическим полем одного ядра,
так что по сравнению с этим отклонением
все прочие отклонения, вместе взятые,
пренебрежимо малы. Соответствующее
рассеяние называется резерфордовским.
см. В таких случаях при рассеянии на
большие углы можно было не учитывать
многократные столкновения α-частицы с
атомными ядрами. Вероятность двукратных,
а тем более многократных столкновений
с большими отклонениями ничтожна.
Ничтожна вероятность рассеяния на
большие углы и на электронах ввиду
малости их масс. Многократные столкновения
с ядрами и с электронами атомных оболочек
играют роль только при очень малых углах
рассеяния. Такие углы мы исключим из
рассмотрения. Тогда, учитывая взаимодействие
α-частицы только с одним ядром, к которому
α-частица подходит наиболее близко, мы
придем к задаче двух тел. От всех остальных
ядер α-частица проходит много дальше,
и поэтому взаимодействием с ними
пренебрегается. Таким образом, теория
Резерфорда применима для больших
отклонений, когда отклонение вызывается
только электрическим полем одного ядра,
так что по сравнению с этим отклонением
все прочие отклонения, вместе взятые,
пренебрежимо малы. Соответствующее
рассеяние называется резерфордовским.
Сечение рассеяния
Рассеяние частиц ядрами происходит
из-за их кулоновского отталкивания.
Поэтому ясно, что рассеиваться будут
не только те частицы, прицельный параметр
которых меньше радиуса ядра. Предположив,
что почти вся масса атома сосредоточена
в положительно заряженном ядре, имеющим
ничтожно малые размеры, Резерфорд
получил выражение для дифференциального
сечения рассеяния α-частиц атомными
ядрами: ds/dW = (Qe/2vp)![]() /(sin(j/2)
/(sin(j/2)![]() )
)![]() ,
получившее название формулы Резерфорда.
Здесь Q - заряд ядра, v, p - скорость и
импульс a-частицы, j - угол рассеяния, ds
- дифференциальное сечение рассеяния,
имеющее размерность площади, dW - телесный
угол в котором наблюдается рассеяние.
Расчётное сечение оказалось прекрасно
совпадающим с опытными данными, если
абсолютную величину заряда считать
равной Ze, где Z-атомный номер элемента.
,
получившее название формулы Резерфорда.
Здесь Q - заряд ядра, v, p - скорость и
импульс a-частицы, j - угол рассеяния, ds
- дифференциальное сечение рассеяния,
имеющее размерность площади, dW - телесный
угол в котором наблюдается рассеяние.
Расчётное сечение оказалось прекрасно
совпадающим с опытными данными, если
абсолютную величину заряда считать
равной Ze, где Z-атомный номер элемента.
Тема
Теория Бора для атома водорода, круговые орбиты.
Из бесконечного множества электронных орбит, возможных с точки зрения классической механики, осуществляются в действительности только некоторые дискретные орбиты, удовлетворяющие определённым квантовым условиям. Электрон, находящийся на одной из этих орбит, несмотря на то, что он движется с ускорением, не излучает электромагнитных волн (света).
Излучение испускается или поглощается в виде светового кванта энергии
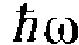 при переходе электрона из одного
стационарного (устойчивого) состояния
в другое. Величина светового кванта
равна разности энергий тех стационарных
состояний, между которыми совершается
квантовый скачок электрона
при переходе электрона из одного
стационарного (устойчивого) состояния
в другое. Величина светового кванта
равна разности энергий тех стационарных
состояний, между которыми совершается
квантовый скачок электрона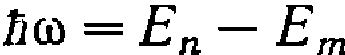 .
Частота излучаемой линии будет равна:
.
Частота излучаемой линии будет равна: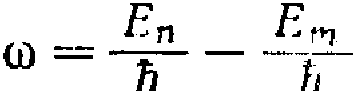
Постулаты Бора заключаются в следующем: Электрон может двигаться вокруг не по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых или квантовых орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую сопровождается потерей энергии. Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Чем больше расстояние от орбиты, на которой находится электрон, до той, на которую он переходит, тем больше частота излучения. Простейшим из атомов является атом водорода; вокруг ядра которого вращается только один электрон. Исходя из приведенных постулатов, Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1 : 2 : 3 : ... n Величина n получила название главного квантового числа. Радиус ближайшей к ядру орбиты в атоме водорода равняется 0,53 ангстрема. Вычисленные отсюда частоты излучений, сопровождающих переходы электрона с одной орбиты на другую, оказались в точности совпадающими с частотами, найденными на опыте для линий водородного спектра. Теория Бора позволила разрешить вопрос о расположении электронов в атомах различных элементов и установить зависимость свойств элементов от строения электронных оболочек их атомов.
