
- •Справочные материалы по химии Содержание
- •Физико-химические постоянные
- •Периодическая система элементов д.И. Менделеева
- •Групповые названия химических элементов
- •Относительные молекулярные массы неорганических соединений
- •Классификация неорганических веществ
- •Амфотерные соединения
- •Растворимость веществ в воде при температуре 25 °с
- •Взаимодействие металлов с водными растворами щелочей
- •Стандартные потенциалы окислительно-восстановительных электродов в щелочной среде
- •Стандартные электродные потенциалы простых веществ
- •Номенклатура кислот
- •Электропроводность слабых электролитов
- •Степень и константа диссоциации некоторых кислот в их децинормальных растворах (0,1 н.) при 18 °с
- •Cильныеэлектролиты:
- •Относительныеэлектроотрицательности элементов
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Стандартные окислительно-восстановительные потенциалы е0в водных растворах при 250с по отношению к нормальному водородному электроду
- •Не расписываются на ионы:
- •Постоянную степень окисления имеют:
- •Алгоритм решения окислительно-восстановительных реакций
- •Гидролиз
- •Жесткость воды
- •Электрохимический ряд напряжений металлов
Взаимодействие металлов с водными растворами щелочей
Металлы, оксиды которых обладают амфотерными свойствами, взаимодействуют в водными растворами щелочей, образуя гидроксокомплексы. В этих реакциях окислителем является вода, из которой восстанавливается водород:
2Н2О + 2ē = Н2 +2ОН- Е0 = +0,83В
Стандартные потенциалы окислительно-восстановительных электродов в щелочной среде
|
Полуреакция |
Е0, В |
Полуреакция |
Е0, В |
|
Cr + 6OH- → [Cr(OH)6]3-+ 3ē |
-0,17 |
Sn + 3OH-(хол.) → [Sn(OH)3]- + 2ē |
-0,9 |
|
Pb + 3OH- → [Pb(OH)3]- + 2ē |
-0,52 |
Sn + 6OH-(гор.) → [Sn(OH)6]2- + 4ē |
-0,93 |
|
Al + 4OH- → [Al(OH)4]- + 3ē |
-2,34 |
Zn + 4OH- → [Zn(OH)4]2-+ 2ē |
-1,26 |
|
Be + 4OH- → [Be(OH)4]2-+ 2ē |
-2,52 |
Ge + 6OH- → [Ge(OH)6]2- + 4ē |
-0,97 |
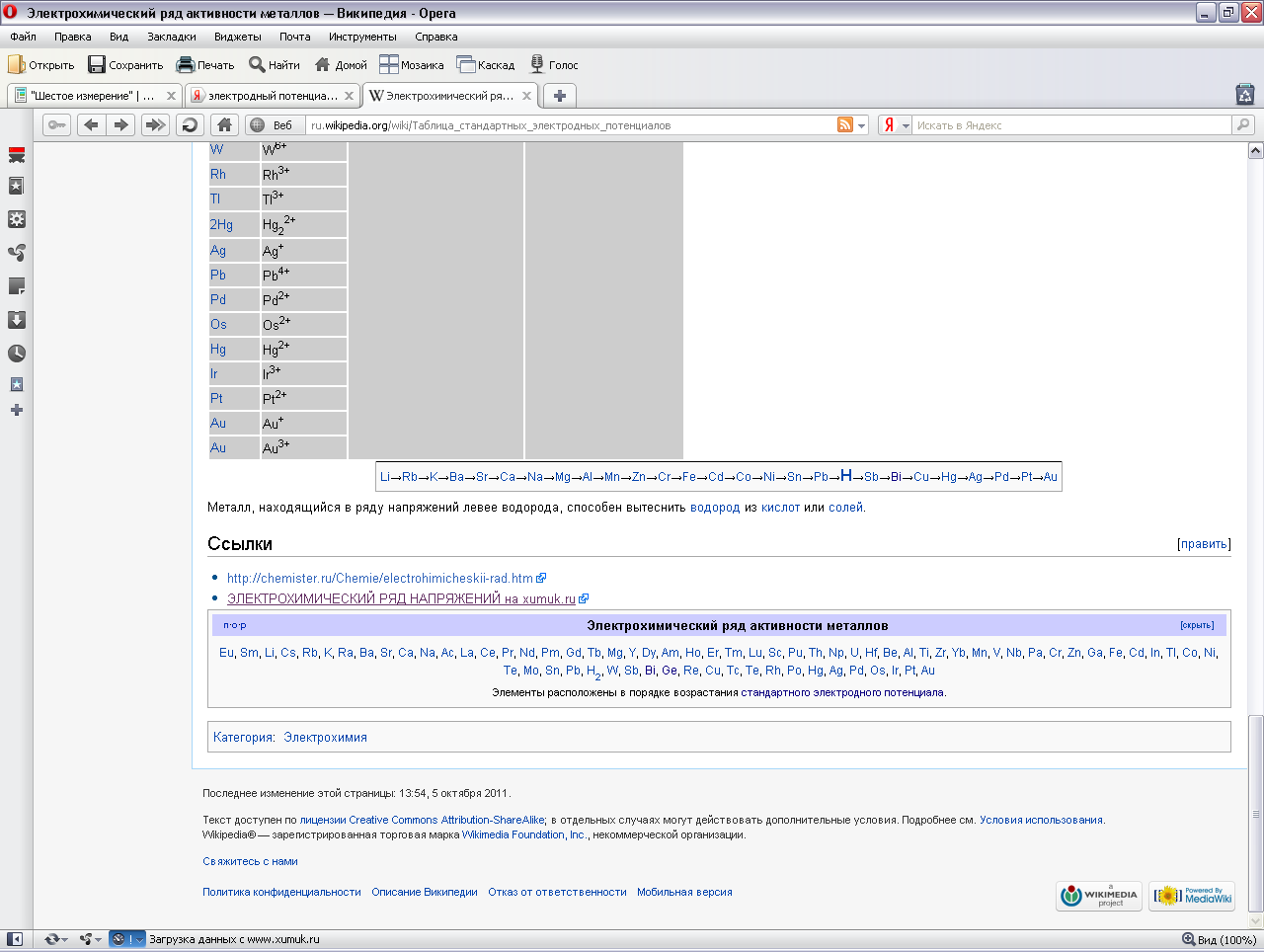
Стандартные электродные потенциалы простых веществ
|
Полуреакция |
Е0, В |
Полуреакция |
Е0, В |
|
Li → Li+ + ē |
-3,045 |
Cr → Cr3+ + 3ē |
-0,74 |
|
K → K+ + ē |
-2,925 |
Ga → Ga3+ + 3ē |
-0,53 |
|
Rb → Rb+ + ē |
-2,925 |
Fe → Fe2+ + 2ē |
-0,44 |
|
Ra → Ra2+ + 2ē |
-2,92 |
Eu → Eu3+ + 3ē |
-0,43 |
|
Ba → Ba2+ + 2ē |
-2,90 |
Cd → Cd2+ + 2ē |
-0,403 |
|
Sr → Sr2+ + 2ē |
-2,89 |
In → In3+ + 3ē |
-0,342 |
|
Ca → Ca2+ + 2ē |
-2,87 |
Tl → Tl + + ē |
-0,336 |
|
Na → Na+ + ē |
-2,714 |
Co → Co2+ + 2ē |
-0,277 |
|
La → La3+ + 3ē |
-2,52 |
Ni → Ni2+ + 2ē |
-0,25 |
|
Ce → Ce3+ + 3ē |
-2,48 |
Mo → Mo3+ + 3ē |
-0,2 |
|
Nd → Nd3+ + 3ē |
-2,44 |
Sn → Sn2+ + 2ē |
-0,136 |
|
Sm → Sm3+ + 3ē |
-2,41 |
Pb → Pb2+ + 2ē |
-0,126 |
|
Cd → Cd3+ + 3ē |
-2,40 |
D2 → 2D+ + 2ē |
-0,003 |
|
Mg → Mg2+ + 2ē |
-2,37 |
H2 → 2H+ + 2ē |
±0,00 |
|
Y → Y3+ + 3ē |
-2,37 |
Cu → Cu2+ + 2ē |
+0,337 |
|
Lu → Lu3+ + 3ē |
-2,25 |
Cu → Cu+ + ē |
+0,521 |
|
Sc → Sc3+ + 3ē |
-2,08 |
I2 (тверд.) + 2ē → 2I- |
+0,536 |
|
Pu → Pu3+ + 3ē |
-2,07 |
2Hg → Hg22+ + 2ē |
+0,789 |
|
Th → Th3+ + 3ē |
-1,09 |
Ag → Ag+ + ē |
+0,799 |
|
Np → Np3+ + 3ē |
-1,86 |
Rh → Rh3+ + 3ē |
+0,8 |
|
Be → Be2+ + 2ē |
-1,85 |
Pd → Pd2+ + 2ē |
+0,987 |
|
Hf → Hf4+ + 4ē |
-1,70 |
Br2 (жидк.) + 2ē → 2Br- |
+1,065 |
|
Al → Al3+ + 3ē |
-1,66 |
Pt → Pt2+ + 2ē |
+1,2 |
|
Zr → Zr4+ + 4ē |
-1,63 |
Cl2 (газ) + 2ē → 2Cl- |
+1,359 |
|
Mn → Mn2+ + 2ē |
-1,18 |
Au → Au3+ + 3ē |
+1,50 |
|
Nb → Nb3+ + 3ē |
-1,1 |
Au → Au+ + ē |
+1,68 |
|
Zn → Zn2+ + 2ē |
-0,763 |
F2 (газ) + 2ē → 2F- |
+2,65 |
http://ru.wikipedia.org/wiki/Таблица_стандартных_электродных_потенциалов
