
- •Справочные материалы по химии Содержание
- •Физико-химические постоянные
- •Периодическая система элементов д.И. Менделеева
- •Групповые названия химических элементов
- •Относительные молекулярные массы неорганических соединений
- •Классификация неорганических веществ
- •Амфотерные соединения
- •Растворимость веществ в воде при температуре 25 °с
- •Взаимодействие металлов с водными растворами щелочей
- •Стандартные потенциалы окислительно-восстановительных электродов в щелочной среде
- •Стандартные электродные потенциалы простых веществ
- •Номенклатура кислот
- •Электропроводность слабых электролитов
- •Степень и константа диссоциации некоторых кислот в их децинормальных растворах (0,1 н.) при 18 °с
- •Cильныеэлектролиты:
- •Относительныеэлектроотрицательности элементов
- •Эбуллиоскопические (Кэ) и криоскопические (Ккр) константы некоторых растворителей
- •Произведения растворимости некоторых малорастворимых электролитов при 25 °с
- •Возможные степени окисления элементов
- •Электронное строение атомов в основном состоянии
- •Стандартные термодинамические функции образования
- •Стандартные окислительно-восстановительные потенциалы е0в водных растворах при 250с по отношению к нормальному водородному электроду
- •Не расписываются на ионы:
- •Постоянную степень окисления имеют:
- •Алгоритм решения окислительно-восстановительных реакций
- •Гидролиз
- •Жесткость воды
- •Электрохимический ряд напряжений металлов
Электропроводность слабых электролитов
Вещества, растворы которых проводят электрический ток, называются электролитами. Процесс диссоциации электролита, в общем виде:
АК ↔ А– + К+.
Согласно электролитической теории электролитов (П. Дабай) сильные электролиты в разбавленных растворах нацело диссоциируют на ионы, например:
H2SО4 ↔ 2 Н+ + SО42–.
NaOH ↔ Na+ + OH–
Согласно теории Аррениуса, диссоциация электролитов – процесс обратимый, поэтому в растворах электролитов наблюдается равновесие между ионами и недиссоциированными молекулами.
Степенью диссоциации (α) –это отношение числа молекул, распавшихся на ионы (n1, моль), к общему числу молекул растворенного вещества (n0, моль).
![]() .
.
Если степень диссоциации электролита при его концентрации 0,1 моль/л превышает 30 %, то электролиты называются сильными. Для слабых электролитов α < 3 %. Все остальные являются электролитами средней силы.
Сила кислот и гидроксидов связана с их степенью диссоциации: чем больше степень диссоциации, тем сильнее соответствующая кислота или щелочь.
Степень и константа диссоциации некоторых кислот в их децинормальных растворах (0,1 н.) при 18 °с
|
Название кислоты |
Формула |
α, % |
Кд |
|
Азотная |
HNO3 |
92 |
- |
|
Соляная |
НС1 |
91 |
- |
|
Бромоводородная |
НВг |
90 |
- |
|
Иодоводородная |
HI |
90 |
- |
|
Серная |
H2SO4 |
58 |
- |
|
Фосфорная |
Н3РО4 |
27 |
К1 = 7,5∙10-3, K2 = 6,2∙10-8, K3=2,2∙10-13 |
|
Сернистая |
H2SO3 |
20 |
K1 = 1,7∙10-2, K2 = 6,2∙10-8 АГ2=6,2-10-8 |
|
Фтороводородная |
HF |
8,5 |
K =7,2 ∙10-4 |
|
Азотистая |
HNO2 |
6,4 |
K = 4 ∙10-4 |
|
Муравьиная |
HCOOH |
4,2 |
К = 1,76∙10-4 |
|
Уксусная |
СНзСООН |
1,3 |
К = 1,75∙10-5 |
|
Угольная |
H2CO3 |
0,17 |
К1 = 4,3∙10-7, K2 = 5,6∙10-11 |
|
Сероводородная |
H2S |
0,07 |
К1 = 5,7∙10-8, K2 = 1,2∙10-15 |
|
Хлорноватистая |
HClO |
0,05 |
К = 3,0∙10-8 |
|
Циановодородная |
HCN |
0,009 |
К = 7,2∙10-10 |
|
Борная |
Н3ВO3 |
0,007 |
К1 = 5,8∙10-10 K2 = 1,8∙10-13 K3=1,6∙10-14 |
Многоосновные кислоты диссоциируют ступенчато. Так, диссоциацию ортофосфорной кислоты можно представить уравнениями:
первая ступень: Н3РО4 ↔ Н+ + Н2РО4–
вторая ступень: Н2РО4– ↔ Н+ + НРО42–
третья ступень: НРО42– ↔ Н+ + PO43–
Константа диссоциации Кд (константа равновесия) характеризует способность электролита диссоциировать на ионы: чем больше Кд, тем больше ионов в растворе. Запишем выражения для констант диссоциации по каждой ступени (численные значения относятся к температуре 18 °С).
![]()
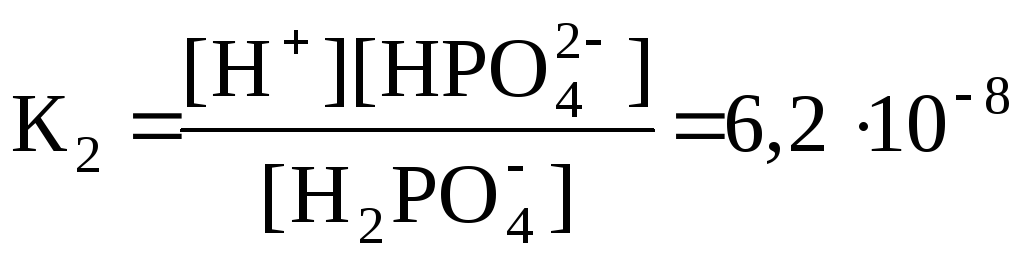

Всегда К1 > К2 > К3, т.е. первичная диссоциация больше вторичной, вторичная больше третичной. Поэтому в растворах таких кислот в заметных количествах имеются только те ионы, которые образуются по первой ступени диссоциации.
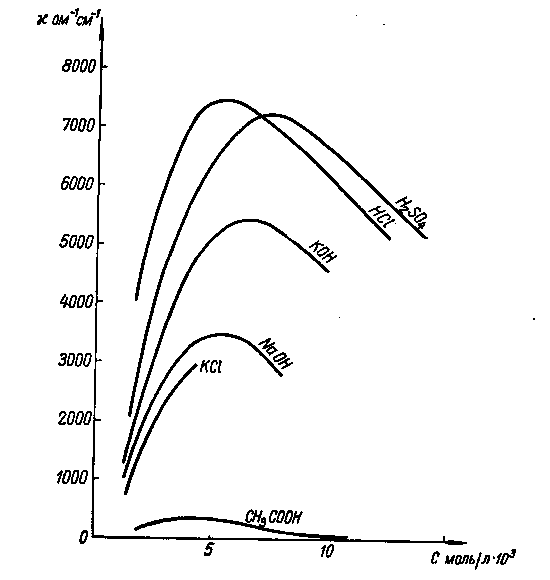
Зависимость удельной электропроводности от концентрации
