
- •Государственное образовательное учреждение
- •2. Расчеты по уравнениям химических реакций
- •3. Вывод химической формулы вещества
- •4. Расчеты по смесям веществ
- •5. Расчеты по закону эквивалентов.
- •Тема 2 Энергетические эффекты химических реакций. Химико-термодинамические расчеты
- •1. Расчеты по термохимическим уравнениям реакций.
- •2. Вычисление стандартных теплот образования веществ и тепловых эффектов химических реакций.
- •3. Вычисления, основанные на взаимосвязи внутренней энергии и энтальпии.
- •4. Вычисление изменения энергии Гиббса в химических реакциях.
- •5. Вычисление изменения энтропии в различных процессах.
- •6. Применение термодинамических функций для характеристики свойств веществ
- •Тема 3 Химическая кинетика и равновесие.
- •Тема 4 Растворы
- •Задания
- •Тема 5 Дисперсные и вяжущие системы
- •Список литературы
3. Вывод химической формулы вещества
Пример 11. Вывести молекулярную формулу вещества, если оно содержит: С – 40,0%, Н – 6,7%, О - 53,3%. 300 см3 паров вещества имеют массу при н.у. 0,8 г.
Решение. В общем виде формулу можно представить так: CxHyOz.
На основе закона постоянства состава можно записать:
12x : y : 16z = 40,0 : 6,7 : 53,3, отсюда
x : y : z = 40,0/12 : 6,7 : 53,3/16; т.е. x : y : z = 3,33 : 6,7 : 3,33.
Далее отношение дробных чисел заменяется отношением целых чисел (меньшее принимается за единицу): x : y : z = 1 : 2 : 1.
Следовательно, простейшая формула вещества СН2О.
Для нахождения истинной формулы вещества надо молярную массу простейшей формулы сопоставить с молярной массой данного вещества.
Из данных задачи находим молярную массу искомого вещества:
М(CxHyOz) = 0,8·22,4/0,3 = 60 г/моль. М(СН2О) = 30 г/моль.
Находим отношение этих двух величин: М(CxHyOz)/ М(СН2О) = 60/30 = 2.
Значит, для нахождения истинной формулы вещества надо состав простейшей формулы увеличить в 2 раза. Таким образом, истинная формула вещества будет С2Н4О2.
Ответ: формула вещества С2Н4О2.
Пример 12. При сжигании 5,6 л газа было получено 16,8 л СО2 и 13,5 г Н2О. 1 л газа имеет массу при н.у. 1,875 г. Какова молекулярная формула газа?
Решение. Образование оксида углерода (IV) при сгорании вещества указывает на наличие в нем атомов углерода. Находим массу углерода в 16,8 л СО2:
12 : 22,4 = m(C) : 16,8, m(C) = 12 · 16,8/ 22,4 = 9 г.
Образование воды в продуктах сгорания вещества свидетельствует о наличии в нем атомов водорода. Находим массу водорода в 13,5 г Н2О:
2 : 18 = m(H) : 13,5, m(H) = 2·13,5/18 = 1,5 г.
Окончательный качественный состав устанавливаем путем проверки наличия в нем кислорода. Для этого находим массу 5,6 л газа:
m(газа) = ρV = 1,875·5,6 = 10,5 г.
Масса углерода и водорода (по предыдущим расчетам) равна: 9+1,5=10,5 г.
Отсюда делаем вывод, что вещество состоит только из атомов углерода и водорода.
Находим простейшую формулу газа:
12x : y = 9 : 1,5
x : y = 0,75 : 1,5
x : y = 1 : 2
Простейшая формула газа – СН2.
Молярная масса газа: М(газа) = 1,875·22,4 = 42 г/моль. М(СН2) = 14 г/моль.
М(СxHy) : M(CH2) = 42 : 14 = 3.
Отсюда истинная формула газа С3Н6.
Ответ: формула газа С3Н6.
4. Расчеты по смесям веществ
Пример 13. Определите массовую долю (%) меди в смеси с железом и алюминием, при хлорировании которой израсходован хлор объемом 8,96 л (н.у.). При взаимодействии такой же навески смеси с соляной кислотой затрачен раствор, содержащий 18,25 г НСl; при действии на такую навеску раствора щелочи израсходован гидроксид натрия массой 2 г.
Решение.
а) Из данных трех металлов (Al, Fe, Cu) только алюминий взаимодействует с раствором щелочи, поэтому можно вычислить массу алюминия в смеси:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
ν(NaOH) =m/M = 2/40 = 0,05 моль, М(NaOH) = 40 г/моль.
Из уравнения реакции следует, что 0,05 моль NaOH реагирует с таким же количеством вещества Al, т.е. ν(Al) = 0,05моль.
m(Al) = νM(Al) = 0,05·27 = 1,35 г.
б) Только алюминий и железо реагируют с раствором соляной кислоты. Можно вычислить количество вещества HCl, прореагировавшего с алюминием, а затем – по оставшемуся количеству вещества HCl – массу железа, содержащуюся в смеси. ν(HCl) =m/M = 18,25/36,5 = 0,5 моль, где M(HCl) = 36,5 г/моль.
2Al + 6HCl = 2AlCl3 + 3H2
По уравнению реакции:
2 моль Al - 6 моль HCl
0,05 моль Al - x моль HCl
x = 0,05·6/2 = 0,15 моль.
ν(HCl) = 0,5 – 0,15 = 0,35 моль - такое количество вещества HCl вступит в реакцию с железом: Fe + 2HCl = FeCl2 + H2. По уравнению реакции:
1 моль Fe - 2 моль HCl
x моль Fe - 0,35 моль HCl
x = 1·0,35/2 = 0,175 моль.
m(Fe) = νM(Fe) = 0,175·56 = 9,8 г.
в) Все металлы взаимодействуют с хлором.
ν(Cl2) = V/VM = 8,96/22,4 = 0,4 моль.
2Al + 3Cl2 = 2AlCl3, по уравнению реакции:
2 моль Al - 3 моль Cl2
0,05 моль Al - x моль Cl2
х = 0,05·3/2 = 0,075 моль
2Fe + 3Cl2 = 2FeCl3, по уравнению реакции
2 моль Fe - 3 моль Cl2
0,175 моль Fe - y моль Cl2
у = 0,175·3/2 = 0,2625 моль
Определяем количество вещества хлора, вступившего в реакцию с медью:
ν = 0,4 – 0,075 – 0,2625 = 0,0625 моль
Cu + Cl2 = CuCl2
Из уравнения реакции следует, что 0,0625 моль Cl2 реагирует с таким же количеством вещества Cu, т.е. ν(Cu) = 0,0625 моль.
m(Cu) = νM(Cu) = 0,0625·64 = 4,0 г.
г) Вычисляем массовую долю меди в смеси.
m(смеси) = m(Al) + m(Fe) + m(Cu) = 1,35 + 9,8 + 4,0 = 15,15 г.
ω(Cu) = m(Cu)/m(смеси) = 4,0/15,15 = 0,264 или 26,4%.
Ответ: ω(Cu) = 26,4%.
Пример 14. При восстановлении водородом смеси оксидов железа (II) и (III) массой 37 г получено железо массой 28 г. Рассчитайте массовую долю каждого из оксидов в смеси.
Решение. Составляем уравнения протекающих реакций:
1) FeO + H2 = Fe + H2O
2) Fe2O3 + 3H2 = 2Fe + 3H2O
M(FeO) = 72 г/моль; M(Fe2O3) = 160 г/моль; М(Fe) = 56 г/моль.
Обозначим количество вещества FeO в смеси через х, а Fe2O3 – через у:
ν(FeO) = x моль, ν(Fe2O3) = у моль.
Тогда в реакции (1) железа образуется х моль, а в реакции (2) – 2у моль:
ν(Fe) = х + 2у.
Составляем
систему уравнений:
ν(FeO) M(FeO) + ν(Fe2O3) M(Fe2O3) = m(смеси)
ν(Fe) М(Fe) = m(Fe)
72х
+ 160у = 37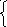
56(х + 2у) = 28
Решив систему уравнений, получаем х = 0,375 моль, у = 0,0625 моль.
Находим массу FeO и Fe2O3 :
m(FeO) = ν(FeO) M(FeO) = 0,375·72 = 27 г;
m(Fe2O3) = ν(Fe2O3) M(Fe2O3) = 0,0625·160 = 10 г.
Вычисляем массовую долю каждого оксида в смеси:
ω(FeO) = 27/37 = 0,73 или 73%.
ω(Fe2O3) = 10/37 = 0,27 или 27%.
