
- •Государственное образовательное учреждение
- •2. Расчеты по уравнениям химических реакций
- •3. Вывод химической формулы вещества
- •4. Расчеты по смесям веществ
- •5. Расчеты по закону эквивалентов.
- •Тема 2 Энергетические эффекты химических реакций. Химико-термодинамические расчеты
- •1. Расчеты по термохимическим уравнениям реакций.
- •2. Вычисление стандартных теплот образования веществ и тепловых эффектов химических реакций.
- •3. Вычисления, основанные на взаимосвязи внутренней энергии и энтальпии.
- •4. Вычисление изменения энергии Гиббса в химических реакциях.
- •5. Вычисление изменения энтропии в различных процессах.
- •6. Применение термодинамических функций для характеристики свойств веществ
- •Тема 3 Химическая кинетика и равновесие.
- •Тема 4 Растворы
- •Задания
- •Тема 5 Дисперсные и вяжущие системы
- •Список литературы
Тема 3 Химическая кинетика и равновесие.
Примеры наиболее важных расчетных задач.
Пример 1. Вычисление скорости реакции по концентрациям реагирующих веществ.
Реакция между веществами А и В протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль/л, а вещества В – 5 моль/л. Константа скорости реакции равна 0,5 л2∙моль-2∙с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
Решение. Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для уравнения реакции в нашем примере
V = к [А]2 [В]
Скорость реакции в начальный момент равна V1 = 0,5∙62∙5 = 90,0 моль∙с-1∙л-1.
По истечении некоторого времени останется 45% В, т.е. 5∙0,45 = 2.25 моль/л. Значит концентрация В уменьшилась на 5 – 2,25 = 2,75 моль/л. Так как вещества А и В взаимодействуют в соотношении 2:1, то концентрация А уменьшилась на 5,5 моль/л (2,75∙2) и стала равной 0,5 моль/л (6-5,5). Следовательно,
V2 = 0,5 (0,5)2∙2,25 = 0,28 моль∙с-1∙л-1.
Пример 2. Определение изменения скорости реакции при изменении температуры.
Вычислите, во сколько раз возрастает скорость реакции при увеличении температуры на 400С, если температурный коэффициент этой реакции равен 3.
Решение. Зависимость скорости химической реакции от температуры выражается эмпирическим правилом Вант-Гоффа, согласно которому при увеличении температуры на 100 скорость реакции увеличивается в 2-4 раза. Число, показывающее, во сколько раз увеличивается скорость химической реакции при повышении температуры на 100, называют температурным коэффициентом γ. Математически правило Вант-Гоаффа можно выразить так:

В
данном примере
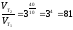
Пример 3. Вычисление времени протекания реакции при изменении температуры.
При 353 К реакция заканчивается за 20 с. Сколько времени длится реакция при 293 К, если температурный коэффициент равен 2.
Решение. Между скоростью протекания химических реакций и их продолжительностью существует обратно пропорциональная зависимость
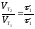 ,
где t1
и t2
- время
протекания реакции при температурах
Т1 и
Т2.
,
где t1
и t2
- время
протекания реакции при температурах
Т1 и
Т2.
Правило
Вант-Гоффа в данном случае можно записать
в виде –
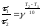 ,
, откуда
откуда
Пример 4. Определение температурного коэффициента реакции.
Найдите температурный коэффициент скорости некоторой реакции, если константа скорости этой реакции при 413 К равна 4,5×10-4л×моль-1×с-1 а при
453 К - 9×10-3л×моль-1×с-1.
Решение. Температурный коэффициент реакции определяют, пользуясь правилом Вант-Гоффа:
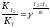 ;
;
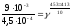 =g4
=g4
20
= g4;
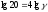 ;
;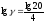
g = 2,115
Пример 5. Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций.
Равновесие реакции А + 3ВÛ2С установилось при следующих концентрациях реагирующих веществ (моль/л): [А] = 2,5; [В] = 1,8; [С] = 3,6. Рассчитайте константу равновесия этой реакции и исходные концентрации А и В.
Решение. Определяем константу равновесия Кр этой реакции
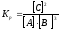 =
=
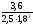 =
0,89
=
0,89
Исходные
концентрации А и В находим на основе
уравнения реакции. На образование 2 моль
С расходуется 1 моль А, а на образование
3,6 моль С потребовалось
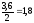 моль А. Учитывая равновесную концентрацию
А, находим его исходную концентрацию:[А]исх
= 2,5 + 1,8 = 4,3
моль/л. На образование 2 моль С необходимо
3 моль В, а для получения 3,6 моль С требуется
3×3,6/2
= 5,4 моль В; [В]исх
= 1,8 + 5,4 = 7,2
моль/л.
моль А. Учитывая равновесную концентрацию
А, находим его исходную концентрацию:[А]исх
= 2,5 + 1,8 = 4,3
моль/л. На образование 2 моль С необходимо
3 моль В, а для получения 3,6 моль С требуется
3×3,6/2
= 5,4 моль В; [В]исх
= 1,8 + 5,4 = 7,2
моль/л.
Пример 6. Вычисление равновесных концентраций реагирующих веществ.
Реакция протекает по уравнению А + В Û 2С. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия – 50 .
Решение.
К моменту наступления равновесия концентрации веществ А и В понизятся, а концентрация С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому если понижение концентрации веществ А и В обозначить через х моль, то увеличение концентрации вещества С будет равно 2х моль.
Равновесные концентрации реагирующих веществ будут:
[А]р = (0,5 - х)моль/л; [В]р = (0,7 – х) моль/л; [С]р = 2х моль/л.
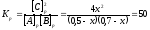
46х2- 60х + 17,5 = 0; Решая это уравнение, получаем х1 = 0,86; х2 = 0,44. По условию задачи справедливо значение х2. Отсюда: [А]р = 0,5 – 0,44 = 0,06 моль/л;
[В]р = (0,7 – 0,44) = 0,26 моль/л; [С] = 2∙0,44 = 0,88 моль/л.
Пример 7. Влияние изменения концентрации реагирующих веществ на смещение равновесия.
Реакция протекает по уравнению 4А + В → 2С + 2Д
В каком направлении сместится химическое равновесие, если концентрацию всех реагирующих веществ увеличить в 2 раза.
Решение. Первоначальные скорости прямой и обратной реакций были следующие:
V→= К1 [А]4[В] ; V← = К2[С]2[Д]2
После увеличения концентраций:
V1→ = К1[2А]4[2В] = 32К1[А]4[В]
V1← = К2[2С]2[2Д]2 = 16К2[С]2[Д]2
т.е. скорость прямой реакции возросла в 32 раза, а скорость обратной – в 16 раз. Следовательно, равновесие сместится вправо (в сторону прямой реакции).
Пример 8. Влияние изменения температуры на смещение химического равновесия.
В какую сторону сместится химическое равновесие реакции АВ А + В, если повысит температуру на 300? Температурные коэффициенты прямой и обратной реакций соответственно равны 2 и 3.
Решение.
При повышении температуры на 300. Скорость прямой реакции возрастает
 ,
а скорость обратной ─
,
а скорость обратной ─
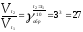
Таким образом, равновесие сместится влево, так как скорость обратной реакции возрастет в 27 раз, а прямой в 8 раз.
Пример 9. Влияние изменения давления на смещение химического равновесия.
Равновесие реакции 2А(г) + В(г)2АВ(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [А] = 0,5; [В] = 0,7;[АВ] = 2,1.
Как изменятся скорости прямой и обратной реакций, если в системе уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия?
Решение.
До уменьшения давления в системе выражения для скоростей прямой и обратной реакций:
V→ = К1[А]2[В] = К1[0,5]2[0,7] = 0,175 К1
V← = К2[АВ]2 = К2[2,1]2 = 4,41 К2
При уменьшении давления в 2 раза концентрации всех реагирующих веществ уменьшится в 2 раза.
Тогда
V1→
= К1
(0,5/2)2(0,7/2)
= 0,0219 К1;
V1←
= К2(2,1/2)2
= 1,1015 К2.
В результате уменьшения давления
скорости прямой и обратной реакций
уменьшились:
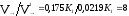 ;
;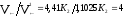
Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой смещение равновесия произойдет справа налево, то есть в сторону разложения АВ.
Пример 10. Вычисление равновесных концентраций реагирующих веществ после смещения равновесия.
Химическое равновесие реакции А + В С + Д установилось при следующих концентрациях реагирующих веществ (моль/л): [А] = 7,[В] = 5, [С] = 10, [Д] = 14.
Равновесие системы было нарушено из-за уменьшения концентрации [Д] до 11 моль/л. Вычислите, какими стали новые равновесные концентрации реагирующих веществ после сдвига равновесия.
Решение.
Из условия задачи видно, что при уменьшении концентрации Д равновесие системы сместится вправо. Это вызовет уменьшение концентраций А и В и увеличение концентраций С и Д. Все вещества в этой реакции реагируют в одинаковом соотношении, поэтому изменение всех концентраций обозначим через х моль/л. Тогда новые равновесные концентрации:
[А]р = 7 – х; [В]р = 5 – х; [С]р = 10 + х; [Д]р = 11 + х.
Константа
равновесия данной реакции
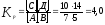 После смещения равновесия:
После смещения равновесия: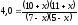 ;
х2
23х + 10 = 0; х = 0,44моль/л. Отсюда: [А]р
= 6,65 моль/л; [В]р
= 4,56 моль/л; [С]р
= 10,44 моль/л; [Д] = 11,44 моль/л.
;
х2
23х + 10 = 0; х = 0,44моль/л. Отсюда: [А]р
= 6,65 моль/л; [В]р
= 4,56 моль/л; [С]р
= 10,44 моль/л; [Д] = 11,44 моль/л.
Задания
Вариант 3.1.
Напишите выражение скоростей прямых и обратных реакций 2NO2 = N2O4 ; NH3(г) + HCl NH4Cl(к)
Как изменится скорость прямой реакции 2SO2 + O2 =2SO3, если увеличить давление в системе в 2 раза?
Как изменится скорость реакции при понижении температуры на 500, если температурный коэффициент реакции равен 2?
Напишите выражения констант равновесия для систем: 2SO2 + O2 2SO3 ; 2S(к) + 2H2O(г) 2H2S(г) + O2(г)
Равновесие реакции установилось при следующих концентрациях:
NO2 = 0,06; NO = 0,24 моль/л, О2 = 0,12 моль/л. Чему равна константа равновесия системы 2NO2 = 2NO + O2.
Как следует изменить давление и температуру, чтобы сместить равновесие реакции С(к) + Н2О(пар) = СО + Н2 вправо? Прямая реакция – эндометрическая.
Как следует изменить концентрации азота и аммиака, чтобы уменьшить выход аммиака в системе: N2 + 3H2 = 2NH3.
Рассчитайте число степеней свободы в системе: 2Na(к) + Cl2(г) 2NaCl(к)
Вариант 3. 2.
Напишите выражения скоростей прямых и обратных реакции N2O4
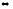 2NO2;
Al2(SO4)3(к)
Al2O3(к)
+ 3SO3(г)
2NO2;
Al2(SO4)3(к)
Al2O3(к)
+ 3SO3(г)При температуре 1500 некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент скорости реакции равным 2, рассчитайте через какое время закончится эта реакция, если проводить ее при 2000С?
Как измениться скорость реакции СО2 + С(графит) = 2СО, если объем реакционного сосуда увеличить в 2 раза?
Какие воздействия на систему 4HCl(г) + О2 = 2Cl2 + 2H2O(г) приведут к смещению равновесия влево?
В какую сторону сместится равновесие реакции: 2А
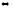 2С
+ Д ─ ∆Н, если увеличить давление в
системе в 2 раза и одновременно понизить
температуру на 300,
причем температурный коэффициент
прямой реакции равен 3, обратной 4.
2С
+ Д ─ ∆Н, если увеличить давление в
системе в 2 раза и одновременно понизить
температуру на 300,
причем температурный коэффициент
прямой реакции равен 3, обратной 4.При нагревании протекает реакция SO2Cl2
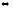 SO2
+ Cl2.
При некоторой температуре из 1 моля
SO2Cl2
разлагается 0,5 моль. Определите константу
равновесия при этой температуре.
SO2
+ Cl2.
При некоторой температуре из 1 моля
SO2Cl2
разлагается 0,5 моль. Определите константу
равновесия при этой температуре.Как следует изменить давление и температуру, чтобы сместить равновесие вправо: Na2CO3 IOH2O(тв) = Na2CO3(тв)+ 10Н2О(пар)? Прямой процесс эндометричен.
Определить число степеней свободы в системе: СаСО3(к) = СаО(к) + СО2
Вариант 3. 3.
Напишите выражения скоростей прямых и обратных реакций:
2NO + Cl22NOCl(г); 2Fe(к) + 3Cl2(г) 2FeCl3(к)
Во сколько раз нужно уменьшить объем реагирующей системы, чтобы скорость прямой реакции 2NO + O22NO2 возросла в27 раз?
Как изменится скорость реакции N2 + 3H2 = 2NH3, если давление в системе увеличить в 2 раза?
Приняв температурный коэффициент равным 3, вычислите, на сколько градусов необходимо повысить температуру, чтобы скорость реакции возросла в 243 раза?
Напишите выражения констант равновесия для систем:
а) N2 + 3H22NH3; б) 2Fe(к) + 3Cl2(г)2FeCl3(к)
Найдите константу равновесия реакции N2O4 = 2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия продиссоциировало 50% N2O4.
Как следует изменить давление в системе СО2 + Сграфит = 2СО, чтобы повысить выход СО?
Определите число степеней свободы в системе: СО2 + Сграфит = 2СО
Вариант 3.4.
Во сколько раз изменится скорость реакции 2А + В = А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества в уменьшить в 2 раза?
Напишите выражение скоростей прямых и обратных реакций
2Na2CO3(к) + СО2 + Н2О(г) 2NaHCO3 (к); 2NOCl (г) 2NO + Cl2
Как измениться скорость реакции при понижении температуры на 300, если температурный коэффициент скорости реакции равен 3?
Напишите выражения констант развития для систем:
а)
H2(г)
+ S(к)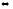 H2S(г);
б) Са(ОН)2(к)СаО(к)
+ Н2О(г)
H2S(г);
б) Са(ОН)2(к)СаО(к)
+ Н2О(г)
Равновесие реакции H2 + J2 = 2HJ установилось при следующих концентрациях: Н2 = 0,25 моль/л, J2 = 0,05 моль/л, HJ = 0,9моль/л. Вычислить исходные концентрации Н2 и J2.
Как следует изменить концентрации PCl5 и Cl2, чтобы увеличить процентное содержание PCl3 в системе: PCl5 PCl3 + Cl2?
Как повлияет на равновесие системы CaCO3(к) = СаО(к) + СО2, Н = 179 кДж, повышение температуры?
Определить число степеней свободы в системе: H2 + S (к) = H2S(г).
Вариант 3. 5.
Напишите выражения скоростей прямых и обратных реакций:
2Cr(к) = 3Сl2(г) 2СrCl3(к); 3C2H2 C6H6
Во сколько раз возрастет скорость реакции 2Н2 + О2 = 2Н2О при увеличении концентрации водорода в 3 раза?
Во сколько раз возрастет скорость реакции при повышении температуры на 500? Температурный коэффициент равен 2.
Температурный коэффициент скорости реакции 2NO22NO + O2 равен 2. Вычислите константу скорости этой реакции при 600 К, если при 640 К константа скорости равна 407,0 лмоль-1с-1.
В каком направлении смещается равновесие реакции СН4 + Н2ОСО + 2Н2 при увеличении объема в 3 раза?
Исходная концентрация каждого из веществ из смеси составляет 1 моль/л:
А + В=С +Д. После установления равновесия [Д] = 1,5 моль/л. Вычислите К равновесия.
В какую сторону сместится равновесие в системе N2 + O22NO при повышении давления?
Рассчитайте число степеней свободы в системе 2BaSO4(к) 2BaSO3(к) + O2
Вариант 3.6.
Напишите выражения скоростей прямых и обратных реакций
2HJ(г) H2 (г) +J2 (г)
2S(к) +2H2O(г) 2H2S(г) +O2
В системе СО +Cℓ2 = COCℓ2 концентрацию СО увеличили от 0,3 до 1,2 моль/л, а концентрацию Сℓ2 – от 0,2 до 0,6 моль/л. Во сколько раз возросла скорость прямой реакции?
Вычислить, во сколько раз уменьшится скорость реакции, если, понизить, температуру от 1200 до 800 С. Температурный коэффициент равен 3.
Константа скорости реакции
N2O5 N2O4 + 1/2О2 при 298 К равна 2,0310-3лмоль-1с-1, а при 288 К равна 4,7610-4лмоль-1 с-1. Найдите температурный коэффициент скорости реакции.
Напишите выражение константы равновесия системы
Na2CO3(к)
+ CO2(г)
+ H2O(пар)
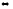 2NaHCO3(к)
2NaHCO3(к)
Вычислить начальную концентрацию хлора в системе CO + Cl2 = COCl2, если равновесие концентрации [Cl2] = 0,3 моль/л, [СО] = 0,3 моль/л, [COCl2] = 1,5 моль/л.
Как следует изменить концентрацию СО и Н2О, чтобы повысить выход СО2?
СО + Н2О = СО2 + Н2
8. Определить число степеней свободы в системе
Na2CO3(к) + СО2 + Н2О(пар) = 2NaHCO3(к)
Вариант 3.7.
Напишите выражения скоростей прямой и обратной реакций:
FeO(к) + CO(г) = Fe(к) + CO2(г)
2BH3(г) = B2H6(г).
Как изменяется скорость прямой реакции 4НСl + О2 = 2Н2О(г)+2Сl, если увеличить давление в два раза?
Вычислите, при какой температуре реакция закончится за 15 минут, если при
300 К на это требуется 60 минут.
Напишите выражение константы развития системы:
FeO(к) + CO(г) Fe(к) + CO2(г)
Какими изменениями концентрации СО2 и давления можно сместить вправо равновесие реакции СО2 + С графит = 2СО?
В какую сторону сместится равновесие в системе: H2 + J2(пары) = 2HJ при увеличении давления вдвое?
Константа равновесия системы 2HJ
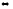 H2
+ J2
равна 0,016. Найдите равновесные концентрации
всех веществ, если вначале было взято
3 моль HJ.
H2
+ J2
равна 0,016. Найдите равновесные концентрации
всех веществ, если вначале было взято
3 моль HJ.Определите число степеней свободы в системе: FeO + CO = Fe + CO2
Вариант 3.8.
Напишите выражение скоростей прямых и обратных реакций:
CaO(к)
+ CO2
(г)
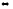 CaCO3(к)
CaCO3(к)
CCl4(г)
+ 4HCl(г)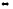 CH4
+4Cl2
CH4
+4Cl2
Как изменится скорость реакции 2NO + O2 = 2NO2, если увеличить концентрацию NO в 3 раза?
Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 70 градусов, если температурный коэффициент реакции равен 2?
Напишите выражение константы равновесия системы:
4Fe(к) + 3O2(г) 2Fe2O3(к)
Равновесные концентрации в системе COCl2 = CO + Cl2 составляют:
[СOCl2] = 4,65 10-5 моль/л, [CO] = 0,001 моль/л, [Cl2] = 0,001 моль/л. Чему равна константа равновесия?
Как следует изменить давление и температуру, чтобы сместить равновесие вправо: С + Н2О(пар) = СО + Н2. Прямая реакция эндотермическая.
Как сместится равновесие в системе N2 + 3Н2 = 2NН3 при увеличении концентрации всех веществ в 2 раза?
Определите число степеней свободы в системе:
СО2 + Сграфит = 2СО
Вариант 3.9.
Напишите выражения скоростей прямых и обратных реакций
CO2(г)
+ С(к)
2СО(г);
H2O(г)
+ С2Н4
 С2Н5ОН(г)
С2Н5ОН(г)
Как изменится скорость прямой реакции 2Н2 + О2 = 2Н2О(пар), если уменьшить объем газовой смеси в 3 раза?
Как изменится скорость реакции при повышении температуры на 300, если температурный коэффициент реакции равен 3?
Напишите выражения констант равновесия следующих обратимых химических реакций:
SFe6(г)
+ 3H2O(г)
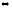 SO3(г)
+ 6HF(г);
Са(к)
+ 2Н2О(г)
SO3(г)
+ 6HF(г);
Са(к)
+ 2Н2О(г)
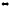 Са(ОН)2(к)
Са(ОН)2(к)
Равновесие реакции установилось при концентрациях:
2NO2 = 2NO +O2, [NO2] = 0,06 моль/л, [NO] = 0,24 моль/л, [О2] = 0,12 моль/л. Чему равна константа равновесия?
В какую сторону сместится равновесие в системе N2O4 = 2NO2 при повышении давления в 3 раза?
Как следует изменить давление, чтобы равновесие в системе 2СО + О2 = 2СО2 сместить вправо?
Определите число степеней свободы в системе: Fe2O3(к) + 3С(к) 2Fe(к) +3CO(г)
Вариант 3.10.
Напишите выражения скоростей обратных и прямых реакций:
СаСО3(к) СаО(к) + СО2(г); 2N2 + 6H2O(г) 4NH3 + 3O2
Как изменится скорость прямой реакции S(к)+O2 = SO2, если объем системы уменьшится в 4 раза?
Как изменится скорость реакции при повышении температуры от 300 до 700 С, если температурный коэффициент реакции равен 2?
Напишите выражения константы равновесия для систем:
PCl5(г) PCl3(г)
+ Cl2(г);
3Fe(к)
+ 4H2O(г)
PCl3(г)
+ Cl2(г);
3Fe(к)
+ 4H2O(г)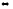 Fe3O4
++ 4H2(г)
Fe3O4
++ 4H2(г)
Константа равновесия реакции СО2 + Н2 = СО + Н2О(г) при 8500 С равна 1. Сколько процентов СО2 подвергается превращению при 8500 С, если смешать 1 моль СО2 и 5 моль Н2?
При состоянии равновесия системы 2Н2 + О2
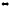 2Н2О(г)
концентрации участвующих веществ были
(моль/л): [Н2]
= 0,3; [О2]
= 0,5; [Н2О]
= 1,5. Рассчитайте, как изменятся скорости
прямой и обратной реакций, если давление
увеличить в 3 раза. В каком направлении
сместится равновесие.
2Н2О(г)
концентрации участвующих веществ были
(моль/л): [Н2]
= 0,3; [О2]
= 0,5; [Н2О]
= 1,5. Рассчитайте, как изменятся скорости
прямой и обратной реакций, если давление
увеличить в 3 раза. В каком направлении
сместится равновесие. Как следует изменить концентрацию N2 и NO, чтобы повысить выход NO?
N2 + O2 = 2NO.
Определите число степеней свободы в системе:
3Fe(к) +4H2O(г) = Fe3O4(к) + 4H2(г)
Вариант 3.11.
Как изменится скорость прямой реакции 2NO + O2 = 2NO2, если уменьшить объем реакционного сосуда в 3 раза?
Напишите выражения скоростей прямых и обратных реакций:
4HCl(г) + O2(г) 2H2O + 2Cl2(г); 2Na(к) + 2H2O(г) 2NaOH(к) +H2(г)
При температуре 1500С реакция заканчивается за 16 минут. Принимая температурный коэффициент реакции равным 3, рассчитать, через какое время закончится эта реакция, если проводить ее при 1100С.
Напишите выражение константы равновесия системы:
4Fe(к) + 3O2(г) 2Fe2О3(к); SF6(г) + 3H2O SO3(г)+ 6HF(г)
5. Найдите константу равновесия реакции N2O4 = 2NO2, если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту наступления равновесия прореагировало 30% N2O4.
6. В каком направлении сместится равновесие системы
2Na2CO3(к) + CO2 +H2O(г) = 2NaHCO3(к) при повышении давления?
В каком направлении сместится равновесие в системе СаСО3 = СаО + СО2 при увеличении концентрации СО2?
Определите число степеней свободы в системе: СО2 + Сграфит = 2СО
Вариант 3.12.
Напишите выражения скоростей прямых и обратных реакций:
Fe3O(к)
+3H2(г)
2Fe(к)
+ 3H2O(г);
SO2Cl2(г)
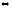 SO2
+ Cl2
SO2
+ Cl2
Как изменится скорость реакции S(к) + O2 = SO2, если объем системы уменьшится в 4 раза?
Как изменится скорость реакции при понижении температуры на 300, если температурный коэффициент реакции равен 3?
Напишите выражения констант равновесия системы: С2Н4(г)+ 3О2(г)
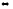 3СО2(г)
+ 2Н2О(г);
SO2(г)
+ CaO(к)
3СО2(г)
+ 2Н2О(г);
SO2(г)
+ CaO(к)
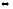 CaSO3(к)
CaSO3(к)Равновесие в системе H2 + J2 = 2HJ установилась при концентрациях 0,25 моль/л H2, 0,05 моль/л J и 0,9 моль/л HJ. Определите исходные концентрации йода и водорода.
Химическое равновесие реакции А + В С установилось при следующих концентрациях веществ (моль/л): [А] = 16, [В] = 14, [С] = 10. Концентрацию вещества С понизили на 5 моль/л, в результате чего сместилось равновесие. Определите новые равновесные концентрации веществ.
Как повлияет на равновесие реакции 2Н2 + О2 = 2Н2О(пар) повышение давления?
Рассчитайте число степеней свободы в системе MgO(к) + CO2(г)
 MgCO3(к)
MgCO3(к)
Вариант 3. 13.
Напишите выражения скоростей прямой и обратной реакций С2Н4 + Cl2 С2Н4Cl2(г); Са(к) + 2Н2О(г) Са(ОН)2(к) + Н2(г)
Как изменится скорость реакции N2 + 3H2 = 2NH3, если увеличить концентрацию водорода в 3 раза?
Приняв температурный коэффициент реакции равным 3, вычислите, на сколько градусов необходимо повысить температуру, чтобы скорость реакции возросла в 81 раз?
Напишите выражения констант равновесия систем: Fe2O3(к) + 3Сграфит 2Fe(к) + 3СО(г); 2SO2(г) + O2(г)
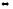 2SO3(г)
2SO3(г)
В системе СО + Cl2 = COCl2 равновесие установилось при концентрациях: 0,3 моль/л Cl2, 0,2 моль/л CO, 1,2 моль/л COCl. Вычислите константу равновесия системы.
Указать, какими изменениями концентраций реагирующих веществ можно сместить равновесие реакции вправо: СО2 + Сграфит
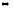 2СО
2СОВ каком направлении сместится равновесие в системе 4HCl + O2 =2Cl2 +2H2O(пар) при уменьшении объема в 3 раза?
Рассчитайте число степеней свободы в системе MgO + CO2 = MgCO3
Вариант 3. 14.
Напишите выражения скоростей прямой и обратной реакций
3Fe(к) + 4Н2О(г) = Fe3О4(к) + 4Н2(г)
Н2
+ СО2
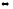 СО
+ Н2О(г)
СО
+ Н2О(г)
Как изменится скорость прямой реакции 2SO2 + O2 = 2SO3, если увеличить концентрацию SO2 в 3 раза?
Константы скорости реакции при 288 и 325 К соответственно равны 2∙10-2 и 0,38 л ∙ моль-1∙с-1. Каковы температурный коэффициент скорости этой реакции и константа скорости этой реакции при температуре 425 К?
Напишите выражение константы равновесия для гомогенной системы
2NО + Cl2 ↔ 2NCl2
Константа равновесия реакции А + В = С + Д равна 1. Начальная концентрация вещества А равна 2 моль/л. Сколько процентов вещества А подвергнется превращению, если начальная концентрация вещества В равна 10 моль/л.
6.В каком направлении сместится равновесие системы
4HCl + O2 = 2H2O(г) + 2Cl2 при увеличении концентрации HCl?
В каком направлении сместится равновесие в системе СО2 + Сграфит = 2СО при повышении давления?
Определите число степеней свободы в системе 4Fe(к) + 3O2(г) = 2Fe2O3(к)
Вариант 3. 15.
Напишите выражения скоростей прямой и обратной реакций
CCl4
+ 4HCl
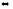 CH4(г)
+ 4Cl2(г);
N2
+ 3H2
2NH3
CH4(г)
+ 4Cl2(г);
N2
+ 3H2
2NH3
Как изменится скорость прямой реакции 2NO + O2 = 2NO2, если уменьшить объем реакционного сосуда в 3 раза?
При температуре 1500С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент реакции равным 2, рассчитать, через какое время закончится эта реакция при 2100С?
Напишите выражения констант равновесия систем:
SO2(г)
+ CaO(к)
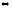 CaSO3(к);
СО + Н2О(г)
CaSO3(к);
СО + Н2О(г)
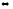 СО2
+ Н2
СО2
+ Н2
Константа равновесия реакции FeO(к) + CO(г) = Fe(к) + CO2 равна 0,5. Найти равновесие концентрации СО и СО2, если исходные концентрации этих веществ были: 0,05 моль/л СО и 0,01 моль/л СО2.
В каком направлении сместится равновесие в системе
PCl5 = PCl3 + Cl2, ∆H = + 130 кДж, при повышении температуры?
Как следует изменить концентрации О2 и Cl2, чтобы сместить равновесие влево в системе 4HCl + O2 = 2H2O(г) + Cl2?
Рассчитать число степеней свободы в системе H2 + S(к) = Н2S
Вариант 3. 16.
Напишите выражение скорости прямой и обратной реакций
2С2Н6 + 7О2 4СО2 + 6Н2О(г)
Как изменится скорость прямой реакции 2NO N2 + O2, если уменьшить давление в системе в 3 раза?
Вычислите, при какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа. Температурный коэффициент скорости реакции равен 3.
Напишите выражения констант равновесия следующих обратимых химических реакций: а) 2NO + O2 2NO2; б) C + CO2
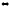 2СО
2СОРассчитайте Кр для реакции PCl5 PCl3 +Cl2 при 500К, если к моменту равновесия продиссоциировало 54% PCl5, а исходная концентрация PCl5 была равна 1 моль/л.
В каком направлении будет смещаться равновесие с повышением температуры для следующих обратимых реакций:
3О2 2О3 Н0298 = +184,6 кДж;
2СО + Н2О(г) 2СО2 + Н2 Н0298 = - 41,2 кДж
В каком направлении будет смещаться равновесие с повышением давления для следующих обратимых реакций: 2CO + O2 2CO2; MgCO3(к) MgO(к) + CO2(г)
Рассчитайте число степеней свободы в системе:
(NH4)2Cr2O7(к) N2 + Cr2O3(к) + 4H2O(г)
Вариант 3. 17.
Напишите выражение скорости прямой и обратной реакций:
С2Н5ОН + 3О2 2СО2 + 3Н2О(г)
В начальный момент протекания реакции N2 + 3H2 2NH3 концентрации были равны (моль/л): N2 = 1,5; H2 = 2,5; NH3 = 0. Каковы концентрации азота и водорода при концентрации аммиака 0,5 моль/л
Определите температурный коэффициент скорости реакции, если при понижении температуры на 450 реакция замедляется в 25 раз.
Определите равновесную концентрацию водорода в реакции:
2HJ H2 + J2 если исходная концентрация HJ составляет 0,55 моль/л, а константа равновесия 0,12.
Напишите выражения констант равновесия следующих обратимых химических реакций: а) 4HCl + O2 2H2O + 2Cl2; б) CH4 + J2 CH3 + HJ
Как повлияет понижение температуры и давления на равновесие следующих обратимых реакций:
а) 2СO CO2 +C H0298 = -172,5 кДж;
б) 2H2S 2H2 + S2 Н0298 = +169,4 кДж
Как следует изменить концентрации СО2 и СН3ОН. Чтобы сместить равновесие вправо в системе СО2 + 2Н2 СН3ОН(г)
Рассчитать число степеней свободы в системеCuO(к) + CO Cu(к) + CO2
Вариант 3. 18.
Напишите выражения скоростей для прямых и обратных реакций:
Pb(к) + CO2 PbO(к) + CO; C4H10 C4H6 + 2H2
Реакция протекает по уравнению Na2S2O3 +H2SO4 Na2SO4 + H2SO3 + S
Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза?
Две реакции при 283 К протекают с одинаковой скоростью. Температурный коэффициент первой и второй реакций равны соответственно 2,5 и 3,0. Как будут относится скорости реакций, если первую из них провести при 350 К, а вторую – при 330 К ?
Напишите выражения констант равновесия следующих обратимых химических реакций: Pb(к) + CO2 PbO(к) + CO; CO2 + H2 CO + H2O
При синтезе фосгена имеет место равновесие реакции Cl2 + CO COCl2. Определите исходные концентрации хлора и оксида углерода, если равновесные концентрации равны (моль/л): Cl2 = 2,5; CO = 1,8; COCl2 = 3,2.
В каком направлении будет смещаться равновесие реакции
СН4 + Н2О СО + 3Н2 при уменьшении объема в 3 раза ?
Каким путем можно повысить выход NO2 в следующих реакциях:
2NO + O2 2NO2 – 113 кДж; N2O4 2NO2 + 58 кДж
Рассчитайте число степеней свободы в системе 4Р(к) + 5О2 2Р2О5(к)
Вариант 3. 19.
Напишите выражения скоростей для прямых и обратных реакций:
2H2O(г) 2H2 + O2; SiO2(к) + 4F2 SiF4(г) + 2OF2(г)
Константа скорости реакции А + 2В 3С равна 0,6. Начальные концентрации: А =2 моль/л и В = 2,5 моль/л. В результате реакции концентрация вещества В оказалась равной 0,5 моль/л. Вычислите, какова концентрация вещества А и скорость прямой реакции.
При 393 К реакция закачивается за 18 минут. Через сколько времени эта реакция закончится при 453 К, если температурный коэффициент скорости равен 3?
Напишите выражения констант равновесия для следующих обратимых химических реакций: 2Fe(к) + 3Cl2 FeCl3(к); 2N2 + 6H2O(г) 4NH3 + 3O2
При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2 2NO + O2 установилось при концентрации диоксида азота – 0,8 моль/л, кислорода 1,1 моль/л, оксида азота – 2,2 моль/л. Вычислите константу равновесия реакции и исходную концентрацию NO2.
В каком направлении будет смещаться равновесие с повышением температуры и давления для следующих обратимых реакций:
2HCl H2 + Cl2 H 0; 2H2S + SO2 3S(к) + 2H2O H 0
Определите, влево или вправо сместится равновесие реакции
Fe2O3(к) + 3CO(г) 2Fe(к) + 3CO2(г) при введении избытка диоксида углерода.
Рассчитайте число степеней свободы в системе ZnS(к) + H2(г) Zn(ж) + H2S(г)
Вариант 3. 20.
Напишите выражение скоростей прямых и обратных реакций:
H2O(г) + C2H4 C2H5OH(г); 2KOH(к) + Cr2O3 (к) 2KCrO2(к) + H2O(г).
Разложение N2O на поверхности золота при высоких температурах протекает по уравнению 2N2O 2N2 + O2. Константа скорости данной реакции равна 510-4. Начальная концентрация N2O 3,2 моль/л. Определите скорость реакции в начальный момент и в тот момент, когда разложится 25% N2O.
На сколько градусов надо повысить температуру, чтобы скорость реакции возросла в 81 раз? Температурный коэффициент равен 3.
Составьте выражение для константы равновесия обратимой химической реакции: S8(к) + 16Н2О(г) 8SO2(г) + 16Н2(г).
Константа равновесия реакции N2 + 3H2 2NH3 равна 0,1. Равновесные концентрации (моль/л): Н2 = 0,6 и NH3 = 0,18. Вычислите начальную и равновесную концентрацию азота.
В каком направлении будет смещаться равновесие с понижением давления для следующих обратимых реакций:
а)
С(к) +
СО2(г)
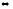 2СО(г);
б) J2(г)
+ 5CO2(г)
2СО(г);
б) J2(г)
+ 5CO2(г)
 J2O5(к)
+ 5CO(г).
J2O5(к)
+ 5CO(г).
В каком направлении сместится равновесие в системе
ZnS(к)
+ H2(г)
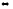 Zn(ж)
+ H2S(г),
если ввести избыток а) Н2,
б) Н2S.
Zn(ж)
+ H2S(г),
если ввести избыток а) Н2,
б) Н2S.
Рассчитайте число степеней свободы в систем
С(к)
+ 2N2O(г)
 CO2(г)
+
2N2(г).
CO2(г)
+
2N2(г).
Вариант 3. 21.
Напишите выражения скоростей прямых и обратных реакций: CCl4 + 4НCl2(г)
 CH4(г)
+ 4Cl2(г);
2S(к)
+ 2H2O(г)
CH4(г)
+ 4Cl2(г);
2S(к)
+ 2H2O(г)
 2H2S(г)
+ O2(г).
2H2S(г)
+ O2(г).Реакция протекает по уравнению 2NH3(г) + 3Cl2(г)
 N2(г)
+ 6HCl(г).
Как изменяется
скорость реакции при увеличении
концентрации Cl2
в 3 раза?
N2(г)
+ 6HCl(г).
Как изменяется
скорость реакции при увеличении
концентрации Cl2
в 3 раза?Определите температурный коэффициент скорости реакции, если при понижении температуры на 500 реакция замедлилась в 32 раза.
Составьте выражение для константы равновесия обратной химической реакции: J2(г) + 5CO2(г)
 J2O5(к)
+ 5CО(г)
J2O5(к)
+ 5CО(г)Константа равновесия обратимой реакции 2NO + O2 2NO2 при 4940 равна 2,2. Сколько молей кислорода надо ввести на каждой литр NO,чтобы окислить 40% NO в NO2, если исходная концентрация NO равна 0,04 моль/л ?
Определите влево или вправо сместится равновесие реакций: CS2 (г) + 3O2
 CO2
+ 2SO2
∆Н
< 0; 2S(к)
+ 2H2O(г)
CO2
+ 2SO2
∆Н
< 0; 2S(к)
+ 2H2O(г)
 2H2S
+ O2
∆Н > 0 при следующих воздействиях: а)
нагревание; б) уменьшение давления.
2H2S
+ O2
∆Н > 0 при следующих воздействиях: а)
нагревание; б) уменьшение давления.Как можно увеличить процентное содержание Сl2 в равновесной системе 2NOCl
 2NO
+Cl2
∆H
> 0
2NO
+Cl2
∆H
> 0Рассчитайте число степеней свободы в равновесной системе
2Fe(к)
+ 3Cl2(г)
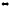 2FeCl3(к).
2FeCl3(к).
Вариант 3. 22.
Напишите выражения скоростей прямых и обратных реакций
2F2
+ H2O(г)
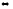 2HF(г)
+ OF2(г);
2Na(к)
+ 2H2O(г)
2HF(г)
+ OF2(г);
2Na(к)
+ 2H2O(г)
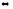 2NaOH(к)
+Н2
2NaOH(к)
+Н2
Инверсия тростникового сахара идет по уравнению:С12Н22О11 + Н2О
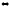 С6Н12О6
+ С6Н12О6.
Первоначальная концентрация сахара
была 1,2 моль/л. Вычислить, какой стала
общая концентрация сахара и продуктов
реакции после того, как проинвертировало
25% сахара.
С6Н12О6
+ С6Н12О6.
Первоначальная концентрация сахара
была 1,2 моль/л. Вычислить, какой стала
общая концентрация сахара и продуктов
реакции после того, как проинвертировало
25% сахара.Напишите выражения констант равновесия следующих, обратимых химических реакций: а) 2ВаО2(к)
 2ВаО(к)
+ О2(г);
б) 2Н2
+ О2
2ВаО(к)
+ О2(г);
б) 2Н2
+ О2
 2Н2О(г).
2Н2О(г).Во сколько раз увеличится скорость растворения железа в 5 %-ной HCl при повышении температуры на 320 , если температурный коэффициент скорости растворения равен 2,8 ?
При которой температуре константа равновесия термической диссоциации N2O4 2NO2 Кр = 0,26. равновесная концентрация NO2 равна 0,28 моль/л. Вычислите равновесную и первоначальную концентрации N2O4 . Какая массовая доля в % этого вещества продиссоциировала к моменту установления равновесия?
6.В каком направлении будет смещаться равновесие с повышением температуры и давления для следующих обратных реакций:
2Cl2(г)
+ 2H2O(г)
4 НCl(г)
+ O2(г)
∆Н > 0;
НCl(г)
+ O2(г)
∆Н > 0;
MgCO3
(к)
 MgO(к)
+ CO2(г)
∆Н > 0
MgO(к)
+ CO2(г)
∆Н > 0
Определите влево или вправо сместится равновесие в системе СО2 + 4Н2
 СН4
+ 2Н2О(ж)
при введении избытка диоксида углерода?
СН4
+ 2Н2О(ж)
при введении избытка диоксида углерода?Рассчитайте число степеней свободы в равновесной системе:
Fe(OH)2(к)
+
 O2(г)
+
O2(г)
+
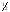 H2O(ж)
H2O(ж)
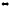 Fe(OH)3(к).
Fe(OH)3(к).
Вариант 3. 23.
1. Напишите выражения скоростей прямых и обратных реакций:
2Pb(к)
+ O2(г)
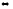 2PbO(к)
2PbO(к)
CO(г)+
Cl2(г)
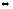 СCl2O(г)
СCl2O(г)
2. Реакция между веществами А и В протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль/л, а вещества В – 5 моль/л. Константа скорости реакции равна 0,5 л . моль-1∙ с-1
Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45% вещества В.
3. Две реакции при 300 К протекают с одинаковой скоростью. Температурный коэффициент первой и второй реакций равны, соответственно 2 и 3. Как будут относится скорости реакций, если первую из них провести при 350 К, а вторую – при 330 К?
4. Напишите выражения констант равновесия следующих обратимых реакций:
2MoO3(к)
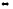 2MoO2(к)
+ O2(г)
2MoO2(к)
+ O2(г)
CH4(г)
+ 2H2S(г)
 CS2
(г)+4H2(г)
CS2
(г)+4H2(г)
5.
Для реакции H2(г)
+ Br2(г)
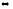 2HBr(г)
при некоторой температуре К = 1. Определите
состав (в % по объему) равновесной
реакционной смеси, если исходная смесь
состояла из 3 молей Н2
и 2 молей
Br2.
2HBr(г)
при некоторой температуре К = 1. Определите
состав (в % по объему) равновесной
реакционной смеси, если исходная смесь
состояла из 3 молей Н2
и 2 молей
Br2.
6. В какую сторону сместится равновесие обратимой реакции при увеличении: а) концентрации хлорида олова (II), б) хлорида олова (IV)
SnCl2
+ 2FeCl3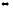 SnCl4
+ 2FeCl2
SnCl4
+ 2FeCl2
7. Определите влево или вправо смещается равновесие в системах
Ca(к)
+ 2H2O2(г)
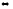 Ca(OH)2(к)
+ H2(г)
∆H
<0
Ca(OH)2(к)
+ H2(г)
∆H
<0
SO2Cl2
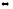 SO2
+ Cl2
∆H
> 0
SO2
+ Cl2
∆H
> 0
а) при понижении температуры
б) при увеличении давления
8. Рассчитайте число степеней свободы в равновесной системе
4Fe(к)
+ 3O2(г)
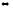 2Fe2O3(к)
2Fe2O3(к)
Вариант 3. 24.
1. Напишите выражения скоростей прямых и обратных реакций
Н2О(г)
+ С2Н4(г)
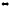 С2Н5ОН(г)
С2Н5ОН(г)
2KOH(к)
+ Cr2O3
(к)
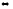 2KCrO2
(к)+ H2O(г)
2KCrO2
(к)+ H2O(г)
2. Определите, как изменится скорость прямой реакции
2СО
+ О2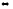 2СО2
2СО2
Если общее давление в системе увеличить в 4 раза.
3. Напишите выражения констант равновесия следующих обратных химических реакций:
С2Н5ОН(г) + 3О2 ↔ 2СО2 + 3Н2О
FeO(к) + H2 ↔ Fe(к) + H2O(г)
4. Вычислите, при какой температуре реакция закончится за 45 минут, если при 290 К на это требуется 2,25 часа. Температурный коэффициент скорости реакции равен 3.
5.
Константа равновесия реакции А + В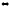 С
+ Д равна единице. Начальная концентрация
[А]0
= 0,02 моль/л. Сколько процентов вещества
А подвергается превращению, если
начальная концентрация [В]0
равна 0,02 моль/л?
С
+ Д равна единице. Начальная концентрация
[А]0
= 0,02 моль/л. Сколько процентов вещества
А подвергается превращению, если
начальная концентрация [В]0
равна 0,02 моль/л?
6. Установите, увеличится или уменьшится равновесный выход продуктов реакции (р, Т = сonst)
NO2(г)
+ SO2(г)
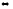 SO3
(г) + NO(г)
при уменьшении концентрации:
SO3
(г) + NO(г)
при уменьшении концентрации:
а) оксида азота (II)
б) оксида серы (IV)
7. Определите, влево или вправо сместится положение равновесия реакций
2HCl(г)
+ Br2
(г)
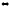 2HBr(г)
+ Cl2(г)
∆H
> 0
2HBr(г)
+ Cl2(г)
∆H
> 0
3Cl2
(г)+ 6NaOH(ж)
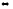 5NaCl(ж)+
NaClO3(ж)+3H2O(г),
∆H
< 0
5NaCl(ж)+
NaClO3(ж)+3H2O(г),
∆H
< 0
8. Рассчитайте число степеней свободы в равновесной системе
NiS(к)
+ H2(г)
 Ni(ж)
+H2S(г)
Ni(ж)
+H2S(г)
Вариант 3. 25.
1. Напишите выражения скоростей прямых и обратных реакций:
C(к)
+ 2N2O(г)
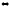 CO2(г)
+ 2N2(г)
CO2(г)
+ 2N2(г)
PCl3(г)
+ Cl2(г)
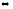 PCl5(г)
PCl5(г)
2. Установите, во сколько раз увеличится скорость реакции
СО(г)
+ 2Н2(г)
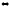 СН3ОН(ж)
СН3ОН(ж)
при увеличении концентрации водорода в 2 раза.
3. Константа скорости некоторой реакции 273 и 293 К соответственно 1,31 и 6,55 л·моль-1·мин-1. Найдите температурный коэффициент скорости реакции.
4. Напишите выражения констант равновесия следующих обратимых химических реакций
СOCl2(г)
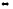 CO(г)
+ Cl2(г)
CO(г)
+ Cl2(г)
Ca(OH)2(ж)
+ 2CO2(г)
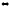 Ca(HCO3)2
(ж)
Ca(HCO3)2
(ж)
5. Химическое равновесие реакции
СО2
+ Н2
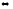 СО + Н2О
установилось при следующих концентрациях
реагирующих веществ (моль/л): [СО2]
= 7, [Н2]
= 5, [СО] = 10, [Н2О]
= 14. Равновесие системы было нарушено
из-за уменьшения концентрации Н2О
до 11 моль/л. Вычислите, какими стали
новые равновесные концентрации
реагирующих веществ после сдвига
равновесия.
СО + Н2О
установилось при следующих концентрациях
реагирующих веществ (моль/л): [СО2]
= 7, [Н2]
= 5, [СО] = 10, [Н2О]
= 14. Равновесие системы было нарушено
из-за уменьшения концентрации Н2О
до 11 моль/л. Вычислите, какими стали
новые равновесные концентрации
реагирующих веществ после сдвига
равновесия.
6. В каком направлении будет смещаться равновесие с повышением температуры и давления для следующих обратимых реакций:
N2O4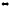 2NO2
∆H0298
= +58,4 кДж
2NO2
∆H0298
= +58,4 кДж
2NO
+ Cl2
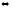 2NOCl
∆H0298
= -73,6 кДж
2NOCl
∆H0298
= -73,6 кДж
7. Известны значения константы равновесия следующих реакций при некоторых условиях:
2BaO2(к)
 2BaO(г)
+ O2(г)
; Кр
= 0,3
2BaO(г)
+ O2(г)
; Кр
= 0,3
4Al(к)
+ 3O3
(г)
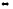 2Al4O3(к)
; Кр
= 1·106
2Al4O3(к)
; Кр
= 1·106
Какие вещества – реагенты или продукты – преобладают в равновесной смеси? Дайте обоснованный ответ.
8. Рассчитайте число степеней свободы в равновесной системе
4Al(к)
+ 3O2(г)
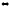 2Al2O3(к)
2Al2O3(к)
Вариант 3. 26.
1. Напишите выражения скоростей прямых и обратных реакций:
2H2O(г)
+ 2Cl2(г)
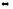 4HCl(г)
+ O2(г)
4HCl(г)
+ O2(г)
СаО(к)
+ СО2(г)
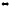 СаСО3(к)
СаСО3(к)
2.
Найдите значение константы скорости
реакции А + В → АВ, если при концентрациях
веществ А и В , равных соответственно
0,05 и 0,01 моль/л, скорость реакции равна
5·10-5(
 ).
).
3. Константа скорости некоторой реакции при 288 К равна 2·10-2. Температурный коэффициент равен 3. Вычислите константу скорости этой реакции при 308 К.
4. Напишите выражения констант равновесия следующих обратимых химических реакций
S8(к) + 16H2O(г) ↔ 8SO2(г) + 16H2(г)
СО2(г) + 4 Н2(г) ↔ СН4(г) + 2Н2О(ж)
5. Для реакции, протекающей в стандартных условиях, найдены следующие значения Кр при разных температурах:
0,003; 1719; 2,5·1011; 1,0; 7,1·10-8. При каком из указанных значений Кр равновесный выход продуктов
а) небольшой, б) наименьший.
6. Равновесные концентрации веществ в реакции
СН3ООН + С2Н5ОН ↔ СН3СООС2Н5 + Н2О
Равны (моль/л): [СН3СООН] = 0,02; [С2Н5ОН] = 0,32; [СН3СООС2Н] = 0,08; [Н2О] = 0,08.
Какими стали равновесные концентрации после смещения равновесия вследствие увеличения концентрации С2Н5ОН в4 раза?
7. Как повлияет уменьшение давления и увеличение температуры на равновесие систем:
2СО ↔ СО2 + С(к) ; ∆Н0298 = -172,5 кДж
4Cr(к) + 3O2(г) ↔ Cr2O3(к) ; ∆Н0298 = -2282 кДж
8. Рассчитайте число степеней свободы в равновесной системе
Cs2O(к) + H2O(ж) ↔ 2CsOH(к)
Вариант 3. 27.
1. Напишите выражения скоростей прямых и обратных реакций
2NH3(г) + 3Cl2(г) N2(г) +6HCl(г)
C(к) + 2N2O(г) CO2 (г)+ 2N2(г)
2. Реакция омыления уксусноэтилового эфира идет по уравнению
СН3СООС2Н5 + NaOH = CH3COONa + C2H5OH
Исходные концентрации реагирующих веществ до начала реакции были: СН3СООС2Н5 = 0,5 моль/л; NaOH = 0,25 моль/л. Вычислите концентрации всех участвующих в реакции веществ в момент, когда СН3СООС2Н5 стала 0,3 моль/л.
3. Константа скорости реакции омыления пропилового эфира уксусной кислоты щелочью при 283 и 293 К соответственно равны 2,15 и 4,30 лмоль-1мин-1. Найдите температурный коэффициент скорости реакции.
4. Укажите, к какому из значений константы равновесия Кр 0, Кр , Кр 1 относятся утверждения (условия стандартные): а) реакция протекает в прямом направлении практически необратимо; б) реакция в прямом направлении почти не протекает, но практически полностью протекает в обратном; в) оба направления протекания реакции практически равновероятны.
5. Равновесие реакции 2NO + O2 2NO установилось при следующих концентрациях реагирующих веществ (моль/л): NO = 0,5; O2 = 0,7; NO2 = 2,1
Как изменятся скорости прямой и обратной реакций, если в системе уменьшить общее давление в 2 раза ? Произойдет ли при этом смещение равновесия реакции?
6. Как повлияет понижение температуры и давления на равновесие обратимых реакций:
P2O5(к) P2O3(к) + O2(г) H 0
3C2H2г) C6H6(г) Н 0
7. Установите увеличится или уменьшится равновесный выход продуктов реакции (р, Т = const)
CS2(г) + 3O2 (г) CO2(г) + 2SO2
а) при увеличении концентрации CS2; б) при уменьшении концентрации СО2
8. Рассчитайте число степеней свободы в равновесной системе
2S(к) + 2H2O(ж) 2H2S(г) + O2(г)
Вариант 3. 28.
1. Напишите выражения скоростей прямых и обратных реакций
2Na(к) + Cl2(г) 2NaCl(к)
2NOCl(г) 2NO(г) + Cl2(г)
2. Во сколько раз и как изменится скорость обратной реакции
2Fe(к) + 3CO2(г) Fe2O3(к) + 3CO(г)
при уменьшении концентрации продуктов реакции в 3 раза.
3. Вычислите, при какой температуре реакция закончится за 30 минут, если при 300 К на это требуется 2 часа. Температурный коэффициент скорости реакции равен 2.
4. Установите, изменится ли (и если да, то как) значение константы равновесия процессов
2А(г) 3В(г) Н0 0
Х(к) + У(ж) Z(г) Н 0
при повышении температуры.
5. Химическое равновесие реакции А + В С + Д установилось при следующих концентрациях веществ (моль/л): А = 18,0; В = 16,0; С = 12; Д = 24,0. Концентрацию С понизили на 12 моль/л, в результате чего сместилось равновесие системы. Определите новые равновесные концентрации реагирующих веществ.
6. Определите, в какую сторону произойдет смещение равновесия реакции
2С2Н6(г) + 7О2(г) 4СО2(г) + 6Н2О(г)
при введении: а) избытка кислорода; б) избытка СО2
7. Как повлияет повышение температуры и давления на равновесие обратимых реакций:
2HCl(г) + Br2(г) 2HBr(г) + Cl2(г) ; Н 0
S(к) + О2(г) SО2(г); Н 0
8. Рассчитайте число степеней свободы для данной равновесной системы
(NH4)2Cr2O7(к) N2(г) + Cr2O3(к) + 4Н2О(г)
Вариант 3. 29.
1. Напишите выражение скоростей прямых и обратных реакций:
SF6 (г)+ 3H2O(г) SO3(г) + 6HF(г)
2BaSO4(к) 2BaSO3(к) + O2(г)
2. Реакция протекает по уравнению
Na2S2O3 + H2SO4 = Na2SO4 + H2SO3 + S
Как изменится скорость реакции после уменьшения концентрации Na2S2O3 в 4 раза?
3. На сколько градусов нужно понизить температуру, чтобы скорость реакции понизилась в 64 раза? Температурный коэффициент равен 2.
4. В каком направлении будет смещаться равновесие реакции
СН4(г) + Н2О(г) СО(г) + 3Н2(г)
при уменьшении объема в 3 раза.
5. Химическое равновесие реакции COCl2 CO + Cl2 установилось при концентрациях реагирующих веществ (моль/л): СOCl2 = 10; CO = 2; Cl2 = 4. В равновесную систему добавили хлор в количестве 4 моль/л. Определите новые равновесные концентрации реагирующих веществ после смещения равновесия.
6. Определите, в какую сторону сместится равновесие в системе
SiO2(к) + 4F2 (г) SiF4(г) + 2OF2(г)
при введении избытка фтора.
7. Как повлияет понижение температуры и понижение давления на равновесие обратимых реакций:
Н2О(г) + С2Н4(г) С2Н5ОН(г); Н 0
2KOH(к) + Cr2O3(к) 2KCrO2(к) + H2O; Н 0
8. Рассчитайте число степеней свободы для данной равновесной системы
2KOH(к) + Cr2O3(к) 2KCrO2(к) + H2O(ж)
Вариант 3. 30.
1. Напишите выражения скоростей прямых и обратных реакций:
СО2(г) + Н2(г) СО(г) + Н2О(г)
SO2г) + CaO(к) CaSO3(к)
2. Реакция выражается уравнением
4HCl + O2 2H2O + 2Cl2
Через некоторое время после начала реакции концентрации участвующих в ней веществ стали (моль/л): HCl = 0,85; O2 = 0,44; Cl2 = 0,30. Какими были концентрации НCl и О2 в начале реакции?
3. Константа скорости некоторой реакции при 300 и 330 К равна соответственно 3,0210-4 и 8,1510-3 лмоль-1мин -1. Найдите температурный коэффициент скорости реакции.
4. Реакция протекает с выделением теплоты
2NO
+ Cl2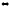 2NOCl;
∆H0298
= -73,6 кДж
2NOCl;
∆H0298
= -73,6 кДж
В сторону какой реакции сместится равновесие, если общее давление в системе понизить в 4 раза и одновременно повысить температуру на 400 (температурные коэффициенты прямой и обратной реакций соответственно равны 2 и 4).
5. Напишите выражения констант равновесия следующих обратимых химических реакций:
С2Н4Сl2(ж)
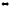 С2Н4(г)
+ Cl2(г)
С2Н4(г)
+ Cl2(г)
СаО(к)
+ СО2(г)
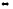 СаСО3(к)
СаСО3(к)
6. Определите: влево или вправо сместится положение равновесия в системе
J2(г)
+ 5СО2(г)
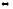 J2O5(к)
+ 5CO(г)
J2O5(к)
+ 5CO(г)
При введении избытка йода.
7. Куда сместится равновесие вследствие уменьшения: а) температуры; б) давления
С3Н8(г)
 С3Н6(г)
+ Н2(г)
; ∆Н < 0
С3Н6(г)
+ Н2(г)
; ∆Н < 0
2MgO(к)
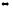 2Mg(к)
+ O2(г);
∆Н > 0
2Mg(к)
+ O2(г);
∆Н > 0
8. Рассчитайте число степеней свободы для данной равновесной системы:
Pb(к)
+ CO2(г)
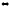 PbO(к)
+ CO(г)
PbO(к)
+ CO(г)
