
- •Государственное образовательное учреждение
- •2. Расчеты по уравнениям химических реакций
- •3. Вывод химической формулы вещества
- •4. Расчеты по смесям веществ
- •5. Расчеты по закону эквивалентов.
- •Тема 2 Энергетические эффекты химических реакций. Химико-термодинамические расчеты
- •1. Расчеты по термохимическим уравнениям реакций.
- •2. Вычисление стандартных теплот образования веществ и тепловых эффектов химических реакций.
- •3. Вычисления, основанные на взаимосвязи внутренней энергии и энтальпии.
- •4. Вычисление изменения энергии Гиббса в химических реакциях.
- •5. Вычисление изменения энтропии в различных процессах.
- •6. Применение термодинамических функций для характеристики свойств веществ
- •Тема 3 Химическая кинетика и равновесие.
- •Тема 4 Растворы
- •Задания
- •Тема 5 Дисперсные и вяжущие системы
- •Список литературы
Тема 4 Растворы
Примеры наиболее важных расчетных задач
Пример. 1. Массовая доля растворенного вещества.
Определите массовую долю (%) хлорида калия в растворе, содержащем 53 г KCl в 0,5 л раствора, плотность которого 1,063 г/л.
Решение.
Массовая доля
 показывает сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора. Массовая
доля – безразмерная величина, ее выражают
в долях единицы или процентах:
показывает сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора. Массовая
доля – безразмерная величина, ее выражают
в долях единицы или процентах:
 =
100
=
100
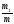 ;
где
;
где − массовая доля (%) растворенного
вещества;m1
– масса растворенного вещества, г; m
– масса раствора, г. Масса раствора
равна произведению объема раствора V
на его плотность ρ
− массовая доля (%) растворенного
вещества;m1
– масса растворенного вещества, г; m
– масса раствора, г. Масса раствора
равна произведению объема раствора V
на его плотность ρ
M
= ρV,
тогда:
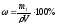 .
Массовая доля хлорида калия в растворе:
.
Массовая доля хлорида калия в растворе: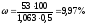
Пример 2. Молярная концентрация раствора.
Какова масса NaOH, содержащегося в 0,2 л раствора, если моляраня концентрация раствора 0,2 моль/л?
Решение. Молярная концентрация (молярность) раствора показывает число молей растворенного вещества, содержащихся в 1 л раствора. Молярную концентрацию (моль/л) выражают формулой
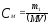 ,
где m1
– масса растворенного вещества, г; М –
его молярная масса, г/моль; V
– объем раствора, л. М(NaOH)
= 40 г/моль. Масса NaOH,
содержащегося в растворе, равна
,
где m1
– масса растворенного вещества, г; М –
его молярная масса, г/моль; V
– объем раствора, л. М(NaOH)
= 40 г/моль. Масса NaOH,
содержащегося в растворе, равна
m1 = СМ ∙ М∙V = 0,2∙40∙0,2 = 1,6 (г).
Пример 3. Молярная концентрация эквивалента.
Определите молярную концентрацию эквивалента хлорида железа (Ш), если в 0,3 л раствора, содержится 32,44 г FeCl3.
Решение.
Молярная концентрация эквивалента
(нормальность раствора) показывает
число молярных масс эквивалентов
растворенного вещества, содержащихся
в 1 л раствора
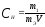 ;
гдеm1
– масса растворенного вещества, г; mэ
– молярная масса эквивалента растворенного
вещества, г/моль; V
- объем раствора, л.
;
гдеm1
– масса растворенного вещества, г; mэ
– молярная масса эквивалента растворенного
вещества, г/моль; V
- объем раствора, л.
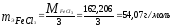
Молярная
концентрация эквивалента FeCl3
равна
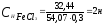
Пример 4. Определите титр 0,01 н КОН.
Решение.
Титр раствора показывает массу (г)
растворенного вещества, содержащегося
в 1 мл раствора.
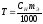 ,
где Т – титр раствора, СН
– молярная концентрация эквивалента,
mЭ
– молярная масса эквивалента растворенного
вещества.
,
где Т – титр раствора, СН
– молярная концентрация эквивалента,
mЭ
– молярная масса эквивалента растворенного
вещества.
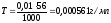 .
.
Пример 5. Для нейтрализации 28 мл H2SO4 потребовалось прибавить 14 мл 0,3 н щелочи. Определите нормальность кислоты.
Решение.
Поскольку вещества взаимодействуют в
эквивалентных количествах, то можно
написать
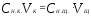 ,
где
,
где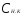 и
и − нормальность кислоты и щелочи;
− нормальность кислоты и щелочи;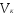 и
и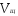 - соответствующие объемы.
- соответствующие объемы.
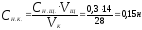 .
.
Пример 6. Вычисление осмотического давления растворов.
Вычислите осмотическое давление раствора, содержащего в 1,4 л 63 г глюкозы С6Н12О6 при 00С.
Решение.
Осмотическое давление раствора определяют
согласно закону Вант-Гоффа:
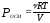 ,
где ν – количество растворенного
вещества, моль;V
– объем раствора, м3;
R
– молярная газовая постоянная, равная
8,31 Дж/(моль∙К). В 1,4 л раствора содержится
,
где ν – количество растворенного
вещества, моль;V
– объем раствора, м3;
R
– молярная газовая постоянная, равная
8,31 Дж/(моль∙К). В 1,4 л раствора содержится
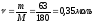 глюкозы. М - молярная масса глюкозы.
Осмотическое давление этого раствора:
глюкозы. М - молярная масса глюкозы.
Осмотическое давление этого раствора:
РОСМ
=
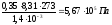 .
.
Пример 7. Определение температуры кипения и замерзания раствора неэлектролита.
Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола С6H5NO2 в 10 г бензола. Эбуллиоскопическая и криоскопическая константы бензола соответственно равны 2,57 и 5,10С. Температура кипения чистого бензола 80,20С, температура замерзания -5,40С.
Решение.
По закону Рауля следует, что
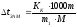 ;
;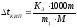 ,
где ∆tзам
и ∆tкип
– соответственно понижение температуры
замерзания и повышение температуры
кипения раствора, Кк
и КЭ
– криоскопическая и эбуллиоскопическая
константы; m
– масса растворенного вещества, г; М –
его молярная масса, m1
– масса растворителя, г.
,
где ∆tзам
и ∆tкип
– соответственно понижение температуры
замерзания и повышение температуры
кипения раствора, Кк
и КЭ
– криоскопическая и эбуллиоскопическая
константы; m
– масса растворенного вещества, г; М –
его молярная масса, m1
– масса растворителя, г.
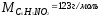 ;
;
∆tкип
=
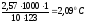 ;tкип
= 80,2 + 2,09 = 82,290C;
∆tзам
=
;tкип
= 80,2 + 2,09 = 82,290C;
∆tзам
=
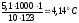 ;
∆tзам
= 5,4 – 4,14 = 1,2600С.
;
∆tзам
= 5,4 – 4,14 = 1,2600С.
Пример 8. Вычисление изотонического коэффициента раствора сильного электролита по осмотическому давлению раствора.
Осмотическое давление 0,1 н ZnSO4 при 00С равно 1,59∙105 Па. Вычислите изотонический коэффициент этого раствора.
Решение.
Изотонический коэффициент i
показывает, во сколько раз значение
осмотического давления Росм,
повышения температуры кипения ∆t’кип
(или понижения температуры замерзания
∆t’зам
) найденные экспериментально, больше
соответствующих значений (Росм,
∆tкип,
∆tзпм.)
для растворов неэлектролитов при той
же молярной концентрации.
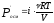 ,
отсюда
,
отсюда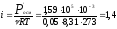 .
0,1 нZnSO4
соответствует 0,05 М ZnSO4.
.
0,1 нZnSO4
соответствует 0,05 М ZnSO4.
Пример 9. Вычисление кажущейся степени диссоциации по значению изотонического коэффициента.
Изотонический коэффициент 0,2 н раствора нитрата кальция равен 2,48. Вычислите кажущуюся степень диссоциации этого электролита.
Решение.
В случае сильных электролитов кажущуюся
степень диссоциации определяют
экспериментально, она всегда меньше
истинной степени диссоциации, которая
близка к единице. Степень диссоциации
и изотонический коэффициент связаны
между собой соотношением
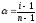 ,
гдеn
– число ионов, образующихся при
диссоциации молекулы электролита. При
диссоциации Ca(NO3)2
образуется три иона.
,
гдеn
– число ионов, образующихся при
диссоциации молекулы электролита. При
диссоциации Ca(NO3)2
образуется три иона.
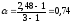 (или 74 %).
(или 74 %).
Пример 10. Вычисление степени диссоциации электролита по осмотическому давлению его раствора.
Рассчитайте кажущуюся степень электролитической диссоциации LiCl в 0,1 М растворе соли, если этот раствор изотоничен с 0,19 М раствором сахара С12Н22О11 при 00С.
Решение.
Моль сахара равен 342,3 г. Осмотическое
давление 0,19 М раствора сахара равно
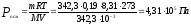 .
.
М(LiCl) = 42,39 (г/моль). По осмотическому давлению определяем изотонический коэффициент раствора LiCl.
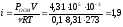
Кажущаяся степень диссоциации в 0,1 М LiCl равна
 (или
90 %).
(или
90 %).
Пример 11. Вычисление степени диссоциации электролита по понижению температуры замерзания его раствора.
Температура замерзания водного раствора, содержащего 0,25 моль HNO3 в 2,5 л воды, равна -0,350С. Рассчитайте кажущуюся степень диссоциации кислоты (КК для воды 1,860С).
Решение.
Молярная масса HNO3
равна 63. Из второго закона Рауля для
электролитов находим значение
изотонического коэффициента:
 .
Кажущаяся степень диссоциацииHNO3
в этом растворе равна
.
Кажущаяся степень диссоциацииHNO3
в этом растворе равна
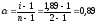 (или 89 %).
(или 89 %).
Пример 12. Вычисление водородного показателя раствора.
Вычислите водородный показатель рН раствора, если концентрация ионов ОН- равна 10-5 моль/л.
Решение.
Исходя из ионного произведения воды
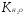 ,
находим концентрацию ионов Н+:
,
находим концентрацию ионов Н+:
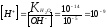 (моль/л).
(моль/л).
Водородный показатель раствора равен: рН = -lg [H+] = -lg 10-9 = 9
