
- •ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА (ЭХМА)
- •1. ПОЛЯРОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •1.1. Рабочая программа
- •1.2. Теоретические основы полярографии
- •1.3. Лабораторная работа «Определение ионов Си2+, Сd2+, Ni2+, Zп2+ при совместном присутствии»
- •1.4. Проблемные вопросы
- •2. АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- •2.1. Рабочая программа
- •2.2. Теоретические основы
- •2.3. Лабораторная работа «Определение Zn2+ (Сd2+) титрованием раствором К4[Fе(СN)6] с двумя платиновыми электродами»
- •2.4. Проблемные вопросы
- •3. ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- •3.1. Рабочая программа
- •3.2. Теоретические основы
- •3.3. Потенциометрическое титрование
- •3.5. Лабораторная работа «Потенциометрическое комплексонометрическое титрование железа (Ш)»
- •3.6. Лабораторная работа «Определение концентрации электролита (кислота, гидролизующаяся соль) методом ионометрии»
- •3.7. Проблемные вопросы
- •4. ПРИКЛАДНАЯ СПЕКТРОСКОПИЯ
- •4.1. Классификация методов
- •4.2. Рабочая программа
- •4.3. Теоретические основы фотометрического анализа
- •4.6. Проблемные вопросы
- •5. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ
- •5.1. Рабочая программа
- •5.2. Классификация тография. методов
- •5.3. Общая характеристика ионообменной хроматографии
- •5.4. Разделение Ni2+ и Zn2+ на анионите АВ-17
- •5.5. Проблемные вопросы и задания
- •ЛИТЕРАТУРА
10
2.АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
2.1.Рабочая программа
Принципы методов амперометрического титрования с использованием одного и двух индикаторных электродов. Типы кривых титрования в обоих вариантах метода. Аппаратура метода. Область применения.
2.2. Теоретические основы
Амперометрическое титрование представляет собой метод объемного анализа, в котором для индикации конечной точки используется явлени диффузионного тока, наблюдаемое на ртутно-капельном или ином электроде с малой поверхностью (см. «Полярографию»).
Теория |
амперометрии, |
в |
главном, есть |
теория |
полярографии, |
обосновывающая прямо |
пропорциональную зависимость величины |
||||
диффузионного тока 1g от концентрации деполяризатора: 1g = К * С.
Метод амперометрии включает в себя два вариан, отличающиеся системой электродов.
Амперометрическое титрование с одним индикаторным электродом>-это классический вариант метода: в качестве индикаторного электрода используют Нg-капающий или твердый вращающийся(Pt, Аи, Аg, спец. сплавы), а второй электрод, электрод сравнения - любой электрод П рода. В данном варианте
обязательными условиями |
являются; протекание электродного процесса с |
участием определяемого вещества или титранта на индикаторном электроде; |
|
правильно выбранное |
поляризующее напряжениеп. ВЕ отличие от |
полярографии удаление растворенного кислорода в методах амперометри
необязательно, т.к. здесь имеет значение не абсолютная величина1 , а ее
§
изменение в процессе титрования - Ig.
Итак, главным является Ig = К * С, изменение концентрации деполяризатора вызывает изменениеIg, сила тока может уменьшаться или увеличиваться, или не изменяться это зависит от электроактивност деполяризатора. Кривые титрования имеют различную форму. Точка конца титрования определяется графически.
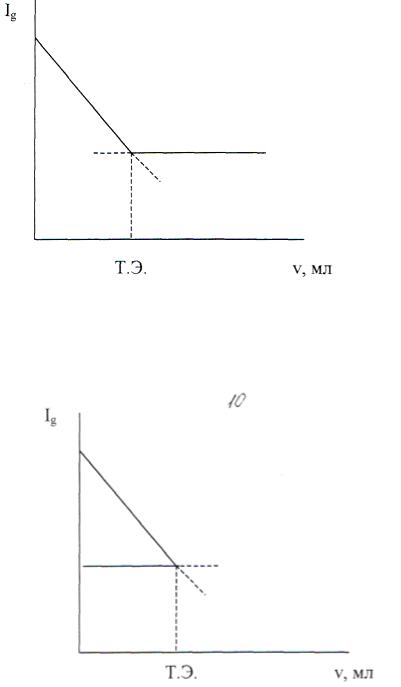
11
Рис. 2.1. Титрование электроактивного вещества неэлектроактивным при заданном напряжении ЕП.
Рис. 2.2. Титрование неэлектроактивного вещества при заданном ЕЛ электроактивным титрантом

12
Рис. 2.3. Титрование электроактивного вещества электроактивным титрантом
Рис. 2.4. Титрование двух веществ, одно |
Рис. 2.5. Кривая титрования по току |
|
из которых электроактивно, второе - |
продукта реакции АsО43'+2Г+2Н+→АsО33- |
|
неэлектроактивно, электроактивным |
+I2+Н2О |
|
титрантом |
|
|
Величина поляризующего напряжения должна быть больше Е 1/2 на 0.1- |
||
0.3 В, при этом регистрируется предельный ток. |
|
|
Амперометрическое титрование |
с двумя |
индикаторными электродами |
обладает тем преимуществом перед классическим, что позволяет титровать |
||
более разбавленные растворы(10 М). |
Электроды |
могут изготавливаться из |
платины, серебра, золота, графита, спец. сплавов и ртути. Главным условием титрования является протекание электродных процессов на обоих электродах. Если возможен лишь катодный или только анодный процесс, тока в цепи ячейки не будет. Кислород из раствора не удаляют; при титровании раствор интенсивно перемешивают. При выборе фонового электролита учитывают, чтобы его ионы не вступали в химическую реакцию с определяемым веществом и
титрантом, а также не участвовали одновременно в обоих электродных процессах. Участие в одном из них иногда полезно.
Форма кривых титрования зависит от электрохимических свойст определяемого вещества и титранта, от величины наложенного напряжения Еп.
Если в растворе создана или образуется при титровании обратимая пара, то ЕП малая величина (от 0 до ~200 мВ, оптимальная ~20~50 мВ).

13
Если обратимых пар не образуется, то поляризующее напряжение выбирается так, чтобы в системемогли возникнуть и катодные и анодные процессы.
Типы кривых титрования:
|
|
Рис. 2.6. Кривая титрования вещества, |
Рис. 2.7. Кривая титрования обратимой |
образующего обратимую пару |
пары титрнтом, тоже образующим |
неэлектроактивным титрантом (I2 + |
обратимую пару (Fе3+ + Sп2+ = Fе2+ + Sп4+) |
2S2032- = 2Г + S4062-) |
|
|
|
Рис. 2.8. Кривая титрования необратимой пары электроактивным титрантом
(2S2032- + 12 = S4062-+ 2Г)
