
ХИМИЯ khimia_posobia_i_testy / Репетиционные_тесты_по_химии_2009
.pdf
РОСЖЕЛДОР Государственное образовательное учреждение
высшего профессионального образования «Ростовский государственный университет путей сообщения»
(РГУПС)
В.Н.Доронькин, Ю.Ф.Мигаль, В.А.Февралева
РЕПЕТИЦИОННЫЕ ТЕСТЫ ПО ХИМИИ
Учебное пособие
Ростов-на-Дону
2009
1

РОСЖЕЛДОР Государственное образовательное учреждение
высшего профессионального образования «Ростовский государственный университет путей сообщения»
(РГУПС)
В.Н.Доронькин, Ю.Ф.Мигаль, В.А.Февралева
РЕПЕТИЦИОННЫЕ ТЕСТЫ ПО ХИМИИ
Учебное пособие
Утверждено методическим советом университета
Ростов-на-Дону
2009
2
УДК 541: 378
Доронькин В.Н., Мигаль Ю.Ф., Февралева В.А.
Репетиционные тесты по химии : учебное пособие / В.Н.Доронькин, Ю.Ф.Мигаль, В.А.Февралева ; Рост. гос. ун-т путей сообщения. – Ростов н/Д, 2009. – 150 с. Библиогр. : 4 назв.
Учебное пособие предназначено для подготовки студентов РГУПС к промежуточной и итоговой аттестации по общей химии, проводимой в тестовой форме. В пособии подробно разбирается методика поиска ответов на демонстрационные тесты, а также приводятся репетиционные тесты, предназначенные для подготовки к аттестации.
Книга предназначена для студентов всех специальностей, изучающих дисциплину «Химия».
Рецензенты: д-р хим. наук, проф. А.Г. Бережная (ЮФУ); канд. техн. наук, доц. Г.Н. Соколова (РГУПС)
©Ростовский государственный университет путей сообщения, 2009
3

Введение
Для подготовки к решению тестов по химии студентам следует изучать теоретический материал по учебникам общей химии, рекомендованным для использования в РГУПС [1 – 3], Пособию по общей химии (под ред. В.М. Виленского) [4] и, безусловно, по лекциям.
Содержание тестов соответствует государственному образовательному стандарту (ГОС) по химии, однако материал приводится в той последовательности, в которой читается курс общей химии в РГУПС.
В пособие включены как авторские разработки преподавателей кафедры химии, апробированные в последние годы в центре тестирования РГУПС, так и тесты, позволяющие осуществить углубленное изучение материала и, в частности, подготовку к интернет-экзамену по химии1. Внимательное изучение предлагаемых в этом пособии тестов позволит вам познакомиться с большинством заданий, которые могут встретиться при выполнении экзаменационного тестового опроса.
По содержанию тесты можно условно разделить на «тесты на узнавание» и тесты, требующие самостоятельного решения различных задач. Методика решения разъясняется в приводимых ниже демонстрационных примерах.
Демонстрационные тесты
Д1. Формулы нерастворимых оснований, солей и кислот соответственно
указаны в ряду: |
|
а) Mg(OH)2, HCl, Ca(NO3)2 |
в) Fe(OH)2, BaSO4, H2SiO3 |
б) Cu(OH)2, H2SiO3, FeS |
г) NaOH, Na2SO4, H2SO3 |
Основаниями называются сложные вещества, состоящие из атомов металла и одной или нескольких гидроксильных групп, например KOH, Ba(OH)2, Al(OH)3.
Кислотами называются сложные вещества, в состав которых входят атомы водороды, способные замещаться на атом металла, и кислотные остатки,
например, HNO3, H3PO4, H2CO3.
Солями называются сложные вещества, в состав которых входят атомы металла (или катионы NH+4) и кислотные остатки, например
FeSO4, NH4NO3, CuCl2, NaHCO3, (CuOH)2CO3.
а) Mg(OH)2 – нерастворимое (проверяем по таблице растворимости) основание
HCl – растворимая кислота
Вывод: одно из веществ не соответствует условию.
1 Тесты, предназначенные для углубленного изучения материала, размещены после тестов базового уровня сложности и отделены знаками « _ * _ ».
3
б) Cu(OH)2 – нерастворимое основание H2SiO3 – нерастворимая кислота
Вывод: нарушен порядок веществ, предложенный в условии – основание
– соль – кислота.
в) Fe(OH)2 – нерастворимое основание BaSO4 – нерастворимая соль
H2SiO3 – нерастворимая кислота.
Вывод: все вещества соответствуют условию. Ответ: в).
Д2. Сокращенное ионное уравнение Al(OH)3 + 3H+ = Al3+ + 3H2O
соответствует взаимодействию |
|
а) Al(OH)3 и H2CO3 |
в) Al(OH)3 и H2S |
б) Al(OH)3 и CH3COOH |
г) Al(OH)3 и HNO3 |
Составляем молекулярные и ионные уравнения реакций:
а) Al(OH)3 + H2CO3
б) Al(OH)3 + CH3COOH = Al(OH)2CH3COO + H2O Al(OH)3 + CH3COOH = Al(OH)2+2 + CH3COO– + H2O
в) Al(OH)3 + H2S
г) Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O
Ответ: г).
Д3. Система – это группа тел, которые а) находятся в окружающей среде и отделены от окружающей среды по-
верхностью; б) взаимодействуют друг с другом и изменяются в результате взаимодей-
ствия с окружающей средой; в) находятся во взаимодействии и мысленно или фактически обособлены
от окружающей среды; г) находятся во взаимодействии, обособлены от окружающей среды и со-
вершают работу против внешних сил.
«Системой называется совокупность находящихся во взаимодействии веществ, мысленно (или фактически) обособленных от окружающей среды». ([1], § IV.1 «Основные понятия и величины в химической термодинамике. Внутренняя энергия и энтальпия».)
Ответ: в).
Д4. Изохорный процесс протекает при постоянном (ой)
а) давлении |
в) объеме |
б) количестве вещества |
г) температуре |
4

«В зависимости от условий перехода системы из одного состояния в другое в термодинамике различают изотермические, изобарические, изохорические и адиабатические процессы. Первые – протекают при постоянной температуре (T = const), вторые – при постоянном давлении (P = const), третьи – при постоянном объеме (V = const), четвертые – в условиях отсутствия обмена теплотой между системой и окружающей средой (q = const)» ([1], § IV.1 «Основные понятия и величины в химической термодинамике. Внутренняя энергия и энтальпия».)
Ответ: в).
|
Д5. Мгновенную скорость гомогенной реакции вычисляют по формуле |
||||||||||
а) v |
|
C |
б) v |
C |
в) v |
dC |
г) v |
|
k C |
|
|
|
|
|
|||||||||
|
T , K |
t |
dt |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
«В химической кинетике различают среднюю и истинную (или мгновен-
ную) скорость реакции. Средняя скорость v равна отношению C/ t ( C = C2 –
– C1; t = t2 – t1). Чтобы величина скорости всегда была положительной, перед дробью ставят знаки « »:
v |
C |
(V.1) |
t |
|
|
|
|
|
Истинная скорость химической реакции vист |
определяется пределом, к ко- |
|
торому стремится отношение C/ t при t → 0, т.е. производной концентрации по времени:
v |
|
|
dC |
|
(V.2)» |
ист |
dt |
|
|||
|
|
|
|||
|
|
|
|
||
([1], § V.1 «Скорость химической реакции».) |
|
||||
Ответ: в). |
|
|
|
|
|
Д6. Скорость прямой реакции CO2(Г) + СТВ 2CO(Г) ... , если увеличить |
|||||
давление в 4 раза. |
|
|
|
|
|
а) увеличится в 4 раза |
|
в) увеличится в 2 раза |
|
||
б) увеличится в 16 раз |
|
г) уменьшится в 2 раза |
|
||
«Современная формулировка закона действующих масс такова: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции». ([1], § V.1 «Скорость химической реакции».)
Концентрацию твердых веществ в выражение для скорости, составленное по закону действующих масс, не включают; для газов вместо концентраций
можно использовать парциальные давления, поэтому v kpCO2 . Следовательно, v2 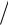 v kp1CO2
v kp1CO2 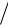 kp2CO2 4.
kp2CO2 4.
5

Ответ: а)
Д7. В какой системе увеличение концентрации водорода смещает химическое равновесие влево?
а) C(ТВ) + 2H2(Г) CH4(Г) |
в) 2H2(Г) + O2(Г) 2H2O(Г) |
б) 2NH3(Г) N2(Г) + 3H2(Г) |
г) FeO(ТВ) + H2(Г) Fe(ТВ) + H2O(Г) |
«Направление смещения положения равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет оказанное воздействие». ([1], § V.5 «Кинетические представления о химическом равновесии».)
На положение равновесия влияют только три фактора – концентрация (для растворов и газов), давление (для газообразных веществ) и температура. Любое другое воздействие – катализатор, ингибитор, перемешивание … – положение равновесия не изменяет, а только изменяет время его установления.
В качестве модели влияния концентрации удобно рассматривать систему сообщающихся сосудов:
а) исходная равновесная система
б) при добавлении вещества (увеличении концентрации) происходит «перетекание», количество добавленного вещества уменьшается и положение равновесия смещается в сторону, ослабляющую оказанное воздействие
в) при удалении вещества (уменьшении концентрации) происходит «перетекание», и положение равновесия смещается в сторону, ослабляющую оказанное воздействие
При увеличении концентрации H2 положение равновесия будет смещаться в системе:
а) C(ТВ) + 2H2(Г) CH4(Г) – вправо, к продуктам реакции
б) 2NH3(Г) N2(Г) + 3H2(Г) – влево, в сторону исходных веществ Ответ: б).
Д8. В какой системе при повышении давления химическое равновесие сместится в сторону исходных веществ?
а) N2(Г) + 3H2(Г) 2NH3(Г) + Q б) C(ТВ) + 2H2(Г) CH4(Г)
в) CO2(Г) + H2(Г) CO(Г) + H2O(Г) + Q г) N2O4(Г) 2NO2(Г) – Q
Направление смещения положения равновесия определяется принципом Ле-Шателье. Давление условно можно связывать с количеством газообразных веществ, входящих в состав равновесной системы. Очевидно, что при повыше-
6

нии давления система должна переходить в состояние с меньшим числом газообразных веществ, ослабляя оказанное воздействие.
Вычисляем количества газообразных веществ в левой и правой частях
уравнения реакции: |
|
|||
а) N2(Г) + 3H2(Г) 2NH3(Г) + Q |
– повышение давления будет смещать по- |
|||
(1 + 3) |
(2) |
ложение равновесия вправо |
||
|
|
P |
|
|
б) |
C(ТВ) + 2H2(Г) CH4(Г) + Q |
|||
|
(0 |
+ 2) |
P (1) |
|
|
|
|
|
|
в) |
CO2(Г) + H2(Г) CO(Г) + H2O(Г) + Q |
|||
|
(1 |
+ 1) |
P (1 + 1) |
|
|
|
|
|
|
–положение равновесия будет смещаться вправо при повышении давления
–давление не влияет на положение равновесия
г) N2O4(Г) 2NO2(Г) |
- Q |
– повышение давления смещает положе- |
||||
(1) |
P |
(2) |
|
ние равновесия влево |
|
|
|
|
|
|
|
|
|
Ответ: г). |
|
|
|
|
|
|
Д9. Какая электронная конфигурация внешнего энергетического уровня |
||||||
соответствует атому элемента VА группы? |
|
|||||
а) 3s23p6 |
|
|
б) 2s22p5 |
в) 4s13d5 |
г) 4s24p3 |
|
Используя правила заполнения атомных орбиталей в многоэлектронном атоме (правила Клечковского), составляем полные электронные формулы атомов, находим число электронов и, следовательно, заряд ядра атома:
а) Э – 1s22s22p63s23p6, число электронов (2 + 2 + 6 + 2 + 6 = ) 18, следовательно Э = 18Ar, находится в главной подгруппе 8-й группы (группа 8А) 3-го периода.
б) Э – 1s22s22p5 , число электронов (2 + 2 + 5 = ) 9, следовательно, Э = 9F, находится во 2-м периоде, главной подгруппе 7-й группы (группа 7А).
в) Ожидаемая электронная формула Э – 1s22s22p63s23p64s23d4, однако более устойчивой (обладающей меньшей энергией) является 1s22s22p63s23p64s13d5 (происходит «проскок» электрона). Порядковый номер элемента 24, соответствует 24Cr, находится в 4-м периоде, побочной подгруппе 6-й группы (6Б
группа).
г) Э – 1s22s22p63s23p64s23d104p3, элемент – 33As, находится в 4-м периоде, главной подгруппе 5-й группы (5А группа).
Ответ: г).
Д10. В каком ряду химические элементы расположены в порядке возрас-
тания их атомного радиуса? |
|
а) Li, Be, B, C |
в) Mg, Si, Cl, Ar |
б) Sb, As, P, N |
г) O, S, Se, Te |
7

Радиус атома по периоду убывает слева направо, по груп- |
|
пе увеличивается сверху вниз. |
RАТОМА |
Определяем положение элементов в периодической системе и закономерность изменения радиуса атома в группе элементов.
а) Li – находится в главной подгруппе 1-й группы 2-го периода Be – находится в главной подгруппе 2-й группы 2-го периода B – находится в главной подгруппе 3-й группы 2-го периода C – находится в главной подгруппе 4-й группы 2-го периода
Вывод: элементы одного периода, радиус атома в рассматриваемой последовательности уменьшается.
б) Sb – находится в главной подгруппе 5-й группы 5-го периода As – находится в главной подгруппе 5-й группы 4-го периода P – находится в главной подгруппе 5-й группы 3-го периода N – находится в главной подгруппе 5-й группы 2-го периода
Вывод: элементы одной группы, радиус атома в рассматриваемой группе уменьшается.
в) Mg – находится в главной подгруппе 2-й группы 3-го периода Si – находится в главной подгруппе 4-й группы 3-го периода Cl – находится в главной подгруппе 7-й группы 3-го периода Ar – находится в главной подгруппе 8-й группы 3-го периода
Вывод: элементы одного периода, радиус атома в рассматриваемой последовательности уменьшается.
г) O – находится в главной подгруппе 6-й группы 2-го периода S – находится в главной подгруппе 2-й группы 3-го периода Se – находится в главной подгруппе 4-й группы 4-го периода Te – находится в главной подгруппе 5-й группы 5-го периода
Вывод: элементы одной группы, радиус атома в рассматриваемой группе увеличивается.
Ответ: г).
Д11. Кислотные свойства водородных соединений усиливаются в ряду:
а) HI – HBr – HCl – HF |
в) HF – NH3 – H2O – CH4 |
б) HCl – H2S – PH3 – SiH4 |
г) H2O – H2S – H2Se – H2Te |
В группе, так как увеличивается радиус атома и, соответственно, увеличивается длина связи Э – Н, то кислотные свойства соединений H2Э усиливаются сверху вниз.
 ислотныек свойства
ислотныек свойства
Н2Э, НЭ
НЭ 
По периоду кислотно-основные свойства летучих водородных соединений изменяются в следующей последовательности: соединения элементов 4-й
8

группы (CH4 …) индифферентны, то есть не взаимодействуют с кислотами и щелочами; водородные соединения элементов 5-й группы проявляют основные свойства (NH3, PH3, …) и далее, при переходе к элементам 7-й группы, происходит усиление кислотных свойств (HF, HCl,…).
изменение кислотно-основных свойст по периоду
IV |
V |
VI |
VII |
нет |
осн. |
амф., кисл. |
кисл. |
а) I находится в главной подгруппе 7-й группы 5-го периода Br находится в главной подгруппе 7-й группы 4-го периода Cl находится в главной подгруппе 7-й группы 3-го периода F находится в главной подгруппе 7-й группы 2-го периода
Вывод: соединения образованы элементами одной группы, кислотные свойства ослабевают.
б) Cl находится в главной подгруппе 7-й группы 3-го периода S находится в главной подгруппе 6-й группы 3-го периода P находится в главной подгруппе 5-й группы 3-го периода Si находится в главной подгруппе 4-й группы 3-го периода
Вывод: соединения образованы элементами одного периода, кислотные свойства ослабевают.
в) F находится в главной подгруппе 7-й группы 2-го периода
Nнаходится в главной подгруппе 5-й группы 2-го периода
Oнаходится в главной подгруппе 6-й группы 2-го периода
Cнаходится в главной подгруппе 4-й группы 2-го периода
Вывод: соединения образованы элементами одного периода, кислотные свойства изменяются не закономерно.
г) O находится в главной подгруппе 6-й группы 2-го периода
S находится в главной подгруппе 6-й группы 3-го периода Se находится в главной подгруппе 6-й группы 4-го периода Te находится в главной подгруппе 6-й группы 5-го периода
Вывод: соединения образованы элементами одной группы, кислотные свойства усиливаются.
Ответ: г).
Д12. Вещества с ковалентной полярной связью находятся в ряду:
а) CO, HF, N2 |
в) NH3, SF6, H2S |
б) KF, HF, CF4 |
г) SO2, NO2, Cl2 |
Ковалентные полярные связи образуются между атомами различных не-
металлов (H–Cl, N–H, P–O, …).
Взаимодействие атомов металла и неметалла приводит к возникновению ионной связи (Na–Cl, Mg–O, K–S,…).
а) C – неметалл, O – неметалл, в CO связь ковалентная полярная H – неметалл, F – неметалл, в HF связь ковалентная полярная
N – неметалл, в N2 – связь ковалентная неполярная (простое вещество, образованное одинаковыми атомами)
9
