
- •1. Предмет орг.Химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура.
- •3. Теория строения Бутлерова. Формулы органических соединений. Формулы Льюиса. Электронная теория строения. Атомная и молекулярная орбитали. Способы образования ковалентной связи.
- •Формулы органических веществ по классам
- •4. Взаимное влияние атомов в молекулах органических соединений. Эффекты электронных смещений. Индуктивный и мезомерный эффекты. Эффект гиперконьюгации. Стерический эффект.
- •Классификация по направлению реакции
- •Нуклеофильные реагенты
- •Электрофильные реагенты
- •6. Кислоты и основания в орг.Химии. Сопряженная кислота и сопряженное основание. Кислотно-основные равновесия, примеры. Влияние заместителей в молекуле на кислотность и основность.
- •7. Типы изомерии в органической химии. Структурная, пространственная и оптическая изомерии. Хиральность. Комформация и конфигурация. R,s, z,e – номенкулатуры.
- •8. Строение алканов. Sp3- состояние углерода. Характеристика связей с-с и с-н. Принцип свободного вращения. Конформация. Способы изображения и номенклатуры. Физические свойства алканов.
- •10. Предельные углеводороды (алканы). Химические и физические свойства: реакции радикального замещения. Галогенирования, нитрирование, сульфохлорирование, сульфоокисление. Понятие о цепных реакциях.
- •Реакции радикального замещения
- •12. Алкены. Гомологический ряд. Номенклатура. Строение. Sp2 – гибридизация. Изомерия. Физические свойства. Способы получения из алканов. Механизм элиминирования. Правило Зайцева.
- •Дегидрирование алканов
- •Гидрирование алкинов
- •Реакции электрофильного присоединения
- •Применение
- •Физические свойства
- •Гидрогенизированный атом углерода – тот атом, к которому присоединен водород. Наиболее гидрогенизированный – там где больше всего н
- •Реакции олигомеризации
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Изомерия
- •Номенклатура
- •1. Нитрование:
- •2. Галогенирование:
3. Теория строения Бутлерова. Формулы органических соединений. Формулы Льюиса. Электронная теория строения. Атомная и молекулярная орбитали. Способы образования ковалентной связи.
Теория строения органических соединений A. M. Бутлерова, сформулированная ученым в 1861г., включает в себя следующие положения: 1 Атомы расположены в молекулах не хаотично, а соединены друг с другом в определенной последовательности, в соответствии с их валентностью. 2. Химические свойства веществ зависят не только от качественного или количественного состава, но и от химического строения молекул. 3. Атомы или группы атомов в молекулах взаимно влияют друг на друга, непосредственно или посредством других атомов.
Формулы органических веществ по классам
Алканы - CnH2n+2
Циклоалканы - CnH2n
Алкены - CnH2n
Алкадиены - CnH2n-2
Алкины - CnH2n-2
Предельные одноатомные спирты - R-OH
Простые эфиры - R – O – R’
карбоновые кислоты - R-COOH
амины. Функциональная группа R -NH2
альдегиды (общая формула (R-COH).
Электронно-точечная формула и формула Льюиса наглядно описывают строение ковалентной связи, но громоздки и занимают много места.
 формула
Льюиса для воды.
формула
Льюиса для воды.
Согласно электронной теории строения вещества, атом любого элемента состоит из электроположительного атомного ядра (состоящего из протонов и нейтронов), в котором сосредоточена вся масса атома, и из электронной оболочки электроотрицательных электронов, которые по сравнению с ядром атома почти не имеют массы.
Ввиду того, что атом в целом является электрически нейтральным, то заряд ядра атома будет равен заряду электронной оболочки, т. е. число электронов будет равно числу протонов.
Электроны обладают отрицательным, а протоны — положительным электрическим зарядом.
Атомные орбитали (АО) характеризуются тремя квантовыми числами: главным n, орбитальным l=0,1,2… и магнитным m=0,+-1,+-2. значениям l = 0, 1, 2, 3, 4,... отвечают буквы s, p, d, f,
Молекулярные орбитали (МО) описывают электрон в поле всех ядер молекулы и усредненном поле остальныхэлектронов.
Существуют два главных способа образования ковалентной связи.
1) Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных атомах.
2) Ковалентные связи могут образовываться за счет спаренных электронов, имеющихся на внешнем электронном слое атома. В этом случае второй атом должен иметь на внешнем слое свободную орбиталь. Атом, предоставляющий свою электронную пару для образования ковалентной связи *, называется донором, а атом, предоставляющий пустуюорбиталь, – акцептором. Ковалентная связь, образованная таким способом, называется донорно-акцепторной связью.
4. Взаимное влияние атомов в молекулах органических соединений. Эффекты электронных смещений. Индуктивный и мезомерный эффекты. Эффект гиперконьюгации. Стерический эффект.
Электронными
эффектами называют
смещение электронной плотности в
молекуле под влиянием заместителей. 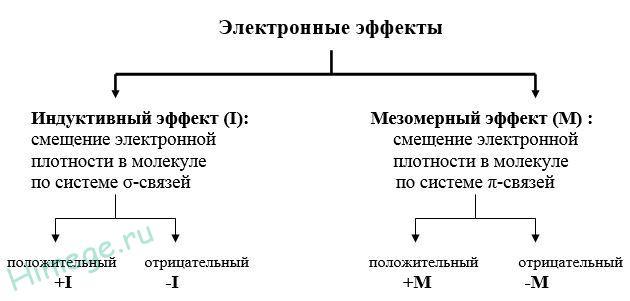
Положительный индуктивный эффект (+I), т.е. эффект смещения электронной плотности от себя, проявляют алкильные радикалы (метил, этил, пропил и т.д.).
Большинство функциональных гpупп (галогены, аминогруппа, нитрогруппа, карбоксильная, карбонильная, гидроксильная гpуппы) проявляет отрицательный индуктивный эффект (–I), т.е. смещают электронную плотность к себе.
Положительный мезомерный эффект (+M), т.е. эффект смещения электронной плотности от себя, проявляют аминогруппа, гидроксильная гpуппа. Нитрогруппа, карбоксильная, карбонильная гpуппы проявляют отрицательный мезомерный эффект (–M), т.е. притягивают электронную плотность к себе.
Эффект, подобный положительному мезомерному, возникает при замещении водорода у кратной связи алкильной группой. Этот эффект направлен в сторону кратной связи и называется гиперконъюгацией (сверхсопряжением). Для проявления эффекта гиперконъюгации необходимо наличие хотя бы одного атома водорода при атоме углерода, соседствующем с пи- системой.
Величина эффекта гиперконъюгации тем выше, чем больше атомов водорода при углероде, связанном с ненасыщенной системой.
Стерический эффект — влияние пространственного объёма молекулы на ход химической реакции. Так, присутствие в молекуле больших групп вблизи от реагирующих атомов может препятствовать сближению этих атомов и замедлить реакцию или сделать её невозможной. Простой пример: химическая формула одинаковая, а взаимное расположение молекул - различно (когда различные конфигурации не достигаются обычным поворотом: например зеркальное отображение). И всё это влияет на свойства вещества, скорость хим. реакции и т.п.
5. Классификация орг.реакций по направлению , механизму, молекулярности. Нуклеофильные и электрофильные реакции и реагенты. Понятие о промежуточных частицах – радикалах, карбкатионах, карбанионах, ион-радикалах. Их строение. Реакции одновалентного переноса.
