
- •1. Предмет орг.Химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура.
- •3. Теория строения Бутлерова. Формулы органических соединений. Формулы Льюиса. Электронная теория строения. Атомная и молекулярная орбитали. Способы образования ковалентной связи.
- •Формулы органических веществ по классам
- •4. Взаимное влияние атомов в молекулах органических соединений. Эффекты электронных смещений. Индуктивный и мезомерный эффекты. Эффект гиперконьюгации. Стерический эффект.
- •Классификация по направлению реакции
- •Нуклеофильные реагенты
- •Электрофильные реагенты
- •6. Кислоты и основания в орг.Химии. Сопряженная кислота и сопряженное основание. Кислотно-основные равновесия, примеры. Влияние заместителей в молекуле на кислотность и основность.
- •7. Типы изомерии в органической химии. Структурная, пространственная и оптическая изомерии. Хиральность. Комформация и конфигурация. R,s, z,e – номенкулатуры.
- •8. Строение алканов. Sp3- состояние углерода. Характеристика связей с-с и с-н. Принцип свободного вращения. Конформация. Способы изображения и номенклатуры. Физические свойства алканов.
- •10. Предельные углеводороды (алканы). Химические и физические свойства: реакции радикального замещения. Галогенирования, нитрирование, сульфохлорирование, сульфоокисление. Понятие о цепных реакциях.
- •Реакции радикального замещения
- •12. Алкены. Гомологический ряд. Номенклатура. Строение. Sp2 – гибридизация. Изомерия. Физические свойства. Способы получения из алканов. Механизм элиминирования. Правило Зайцева.
- •Дегидрирование алканов
- •Гидрирование алкинов
- •Реакции электрофильного присоединения
- •Применение
- •Физические свойства
- •Гидрогенизированный атом углерода – тот атом, к которому присоединен водород. Наиболее гидрогенизированный – там где больше всего н
- •Реакции олигомеризации
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Изомерия
- •Номенклатура
- •1. Нитрование:
- •2. Галогенирование:
Классификация по направлению реакции
Реакции замещения2:
R–Н
+ Сl–Cl ![]() R–Cl
+ НСl,
R–Cl
+ НСl,
Реакции присоединения (по кратным связям):

Реакции отщепления (элиминирования) с образованием кратных связей:
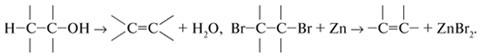 \
\
Рассматривая механизм реакции, прежде всего обращают внимание на способ разрыва ковалентной связи в реагирующей молекуле. Таких способов два – гомолитический и гетеролитический.
Гетеролитические реакции называют ионными, поскольку они сопровождаются образованием органических ионов.
Гомолитические реакции протекают преимущественно в газовой фазе.
Различают нуклеофильные реакции (нуклеофил – ищущий ядро, место с недостатком электронов) и электрофильные реакции (электрофил – ищущий электроны).
Нуклеофильные реагенты
а) нейтральные молекулы, имеющие неподеленные пары электронов:
б) анионы: OH— ; CN—; NH2—; RCOO—; RS—; Cl—; Br—; I—; HSO3—;
в) соединения, содержащие центры с повышенной электронной плотностью:
Электрофильные реагенты
а) нейтральные молекулы, имеющие вакантную орбиталь: SO3, кислоты Льюиса (AlCl3, SnCl4, FeBr3, BF3);
б) катионы: протон (Н+), ионы металлов (Меn+); SO3H+, NO2+, NO+;
в) молекулы, имеющие центры с пониженной электронной плотностью: галогенпроизводные углеводов – Rδ+—Halδ—, галогены (Cl2, Br2, I2), соединения с карбонильной группой
Карбкатионы – положительно заряженные частицы, атом углерода, несущий положительный заряд находится в sр2-гибридизации.
Карбанионы – отрицательно заряженные частицы, заряд которых обусловлен наличием в их структуре атома С с неподеленной электронной парой. При этом атом углерода, несущий отрицательный заряд, может быть как в sp2, так и в sр3-гибридизации.
Свободные радикалы – любая электронейтральная активная частица, содержащая одноэлектронную орбиталь, т.е. неспаренный электрон.
6. Кислоты и основания в орг.Химии. Сопряженная кислота и сопряженное основание. Кислотно-основные равновесия, примеры. Влияние заместителей в молекуле на кислотность и основность.
По Льюису, кислотные и основные свойства органических соединений оцениваются по способности принимать или предоставлять электронную пару с последующим образованием связи. Атом, принимающий электронную пару, является акцептором электронов, а соединение, содержащее такой атом, следует отнести к кислотам. Атом, предоставляющий электронную пару, является донором элекронов, а соединение, содержащее такой атом, – основанием.
Конкретно кислотами Льюиса могут быть атом, молекула или катион: протон, галогениды элементов второй и третьей групп Периодической системы, галогениды переходных металлов – BF3 , ZnCl2 , AlCl3 , FeCl3 ,FeBr3 , TiCl4 , SnCl4 , SbCl5 , катионы металлов, серный ангидрид – SO3 , карбкатион. К основаниям Льюиса относятся амины (RNH2 , R2NH, R3N), спирты ROH, простые эфиры ROR
По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон.
Сопряжённые кислота и основание:
HCN (кисл) и СN-(основание)
NН3(основание) и NH4+ (кислота)
Кислотно-основное (или протолитическое) равновесие– это равновесие в котором участвует протон (Н+).
HCOOH + H2O D H3O+ + HCOO-
кислота1 основание2 сопряженная сопряженное
кислота2 основание1
или
H2O + NH3 D NH4+ + OH-.
кислота1 основание2 сопряженная сопряженное
кислота2 основание1
